
ЎѕМвДїЎї2015ДкЛ№М№ёЈґуС§СРѕїИЛФ±СРЦЖіцТ»ЦЦїЙФЪТ»·ЦЦУДЪНкіЙід·ЕµзµДі¬іЈРФДЬВБАлЧУµзіШЈ¬ДЪІїУГAlCl4ЁCєНУР»ъСфАлЧУ№№іЙµзЅвЦКИЬТєЈ¬Жд·Еµз№¤ЧчФАнИзПВНјЛщКѕЎЈПВБРЛµ·ЁІ»ХэИ·µДКЗ
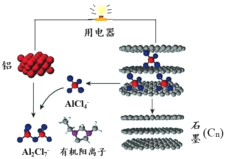
AЈ®·ЕµзК±Ј¬ВБОЄёєј«ЎўКЇД«ОЄХэј«
BЈ®·ЕµзК±Ј¬УР»ъСфАлЧУПтВБµзј«·ЅПтТЖ¶Ї
CЈ®·ЕµзК±µДёєј«·ґУ¦ОЄЈєAl ЁC3e- + 7AlCl4ЁC = 4Al2Cl7ЁC
DЈ®ідµзК±µДСфј«·ґУ¦ОЄЈєCn + AlCl4ЁCЁCe- = CnAlCl4
Ўѕґр°ёЎїB
ЎѕЅвОцЎї
КФМв·ЦОцЈєAЎў·ЕµзК±КЗФµзіШЈ¬ВБКЗ»оРФµзј«Ј¬КЇД«ОЄ¶иРФµзј«Ј¬ВБОЄёєј«ЎўКЇД«ОЄХэј«Ј¬№КAХэИ·Ј»BЎў·ЕµзК±КЗФµзіШЈ¬ФЪФµзіШЦРЈ¬СфАлЧУПтХэј«ТЖ¶ЇЈ¬УР»ъСфАлЧУУЙВБµзј«ПтКЇД«µзј«·ЅПтТЖ¶ЇЈ¬№КBґнОуЈ»CЎўёщѕЭКѕТвНјЈ¬·ЕµзК±Ј¬ВБОЄёєј«Ј¬ВБёъAlCl4ЁC µГµЅµзЧУЙъіЙAl2Cl7ЁCЈ¬ёєј«·ґУ¦ОЄЈєAl ЁC3e- + 7AlCl4ЁC =4Al2Cl7ЁCЈ¬№КCХэИ·Ј»DЎўідµзК±Ј¬Сфј«·ўЙъСх»Ї·ґУ¦Ј¬µзј«·ґУ¦КЅОЄCn + AlCl4ЁC ЁC e- =CnAlCl4Ј¬№КDХэИ·Ј»№КСЎBЎЈ



| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПтТ»ИЭ»эІ»±дµДГЬ±ХИЭЖчЦРідИлТ»¶ЁБїAєНBЈ¬·ўЙъИзПВ·ґУ¦ЈєxA(g)Ј«2B(s) ![]() yC(g)ЎЎ¦¤H<0Ј¬Т»¶ЁМхјюПВЈ¬ИЭЖчЦРAЎўCµДОпЦКµДБїЕЁ¶ИЛжК±јд±д»ЇµДЗъПЯИзНјЛщКѕЎЈЗл»ШґрПВБРОКМвЈє
yC(g)ЎЎ¦¤H<0Ј¬Т»¶ЁМхјюПВЈ¬ИЭЖчЦРAЎўCµДОпЦКµДБїЕЁ¶ИЛжК±јд±д»ЇµДЗъПЯИзНјЛщКѕЎЈЗл»ШґрПВБРОКМвЈє

ЈЁ1Ј©УГAµДЕЁ¶И±д»Ї±нКѕёГ·ґУ¦ФЪ0Ў«10 minДЪµДЖЅѕщ·ґУ¦ЛЩВКv(A)ЈЅ______________________ЎЈ
ЈЁ2Ј©ёщѕЭНјКѕїЙИ·¶ЁxЎГyЈЅ________ЎЈ
ЈЁ3Ј©0Ў«10 minИЭЖчДЪС№Зї________(МоЎ°±дґуЎ±ЎўЎ°І»±дЎ±»тЎ°±дРЎЎ±)ЎЈ
ЈЁ4Ј©НЖІвµЪ10 minТэЖрЗъПЯ±д»ЇµД·ґУ¦МхјюїЙДЬКЗ______________________Ј»µЪ16minТэЖрЗъПЯ±д»ЇµД·ґУ¦МхјюїЙДЬКЗ________________________ЎЈ
ўЩјхС№ЎЎўЪФцґуAµДЕЁ¶ИЎЎ ўЫФцґуCµДБїЎЎ ўЬЙэОВўЭЅµОВЎЎ ўЮјУґЯ»ЇјБ
ЈЁ5Ј©ИфЖЅєвўсµДЖЅєвіЈКэОЄK1Ј¬ЖЅєвўтЖЅєвіЈКэОЄK2Ј¬ФтK1________K2(МоЎ°ЈѕЎ±ЎўЎ°ЈЅЎ±»тЎ°ЈјЎ±)ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї¶МЦЬЖЪФЄЛШWЎўXЎўYЎўZµДФЧУРтКэТАґОФцґуЈ¬ЖдЦРZОЄЅрКфЗТZµДФЧУРтКэОЄWµД2±¶ЎЈnЎўpЎўqКЗУЙХвР©ФЄЛШЧйіЙµД¶юФЄ»ЇєПОпЈ¬іЈОВПВЈ¬nОЄЖшМеЎЈmЎўrЎўs·Ц±рКЗZЎўWЎўXµДµҐЦКЈ¬tµДЛ®ИЬТєіКјоРФСжЙ«·ґУ¦іК»ЖЙ«Ј¬ЙПКцОпЦКјдµДЧЄ»Ї№ШПµИзНјЛщКѕЎЈПВБРЛµ·ЁХэИ·µДКЗ

A. јтµҐАлЧУ°лѕ¶:Z>Y>X B. »ЇєПОпPЦРЦ»ґжФЪАлЧУјь
C. НјКѕЧЄ»Ї№ШПµЙжј°µД·ґУ¦ѕщОЄСх»Ї»№Ф·ґУ¦ D. ЧојтµҐЖшМ¬Зв»ЇОпµДОИ¶ЁРФЈєW>X
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїРїєНВБ¶јКЗ»оЖГЅрКфЈ¬ЛьГЗµДµҐЦКј°»ЇєПОпµДРФЦКѕЯУРТ»¶ЁµДПаЛЖРФЎЈ
ЈЁ1Ј©ПВНј±нКѕіЈОВПВ¶юјЫРїФЪЛ®ИЬТєЦРµДґжФЪРОКЅУлpHµД№ШПµЈ¬єбЧш±кОЄИЬТєµДpHЦµЈ¬ЧЭЧш±кОЄZn2+АлЧУ»т[Zn(OH)4]2-АлЧУОпЦКµДБїЕЁ¶ИµД¶ФКэЈ¬»ШґрПВБРОКМвЈє

ўЩЅ«µҐЦКZnјУИлЧгБїµДЗвСх»ЇДЖИЬТєЦРЈ¬·ґУ¦µДАлЧУ·ЅіМКЅїЙ±нКѕОЄЈє
___________________________________________________________________________
ўЪґУНјЦРКэѕЭјЖЛгїЙµГZn(OH)2µДИЬ¶И»э(Ksp)= _________________________ЎЈ
ўЫНщ1L1.00 molЎ¤L-1ZnCl2ИЬТєЦРјУИлNaOH№ММеЦБpH=6Ј¬РиNaOH ____ molЎЈ
ўЬТСЦЄЈєНщZnCl2ИЬТєЦРјУИлПхЛбЗ¦»тґЧЛбЗ¦ИЬТєїЙТФЦЖµГPbCl2°ЧЙ«ѕ§МеЈ»25ЎжК±Ј¬PbCl2№ММеФЪСОЛбЦРµДИЬЅв¶ИИзПВЈє
c(HCl)/( molЎ¤LЈ1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
c(PbCl2)/( molЎ¤LЈ1)ЎБ10Ј3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
ёщѕЭЙП±нКэѕЭЕР¶ППВБРЛµ·ЁХэИ·µДКЗ____________ЎЈ
AЈ®ЛжЧЕСОЛбЕЁ¶ИµДФцґуЈ¬PbCl2№ММеµДИЬЅв¶И±дРЎ
BЈ®PbCl2№ММеФЪ0.50 molЎ¤L-1СОЛбЦРµДKspРЎУЪФЪґїЛ®ЦРµДKsp
CЈ®PbCl2ДЬУлЕЁСОЛб·ґУ¦ЙъіЙТ»ЦЦДСµзАлµДТхАлЧУЈЁВзєПАлЧУЈ©
DЈ®PbCl2№ММеїЙИЬУЪ±ҐєНКіСОЛ®
ЈЁ2Ј©ЗвСх»ЇРїУлЗвСх»ЇВБµДРФЦКУЦґжФЪТ»¶ЁµДІоТмЈ¬ИзЗвСх»ЇВБІ»ИЬУЪ°±Л®Ј¬¶шЗвСх»ЇРїДЬИЬУЪ°±Л®Ј¬ЙъіЙЕдєПОпАлЧУ[Zn(NH3)4]2+ЎЈ
ўЩФЪ25ЎжПВЈ¬Ѕ«a molLЎЄ1µДNH4ClИЬТєУл0.01molLЎЄ1µДNaOHИЬТєµИМе»э»мєПЈ¬·ґУ¦єуІвµГИЬТєpH=7Ј¬УГє¬aµДґъКэКЅ±нКѕNH4+µДЛ®ЅвіЈКэKh=___________mol LЎЄ1ЎЈ
ўЪИф25ЎжК±Ѕ«ЕЁ¶ИѕщОЄ0.1molLЎЄ1µДNH4ClЎўNH3Ў¤H2OИЬТєµИМе»э»мєПєуЈ¬ИЬТєіКјоРФЈ¬Фт№ШУЪёГИЬТєµДЛµ·ЁІ»ХэИ·µДКЗ____________ЈЁМоЧЦДёЈ©ЎЈ
aЈ®ґЛИЬТєТ»¶ЁУРc(NH4+)+ c ( H+) = c(OHЎЄ) +c ( ClЎЄ)
bЈ®ґЛИЬТєТ»¶ЁУРc(Cl-) = c (NH3Ў¤H2O) +cЈЁNH4+Ј©
cЈ®»мєПИЬТєЦРЛ®µДµзАліМ¶ИТ»¶ЁґуУЪёГОВ¶ИПВґїЛ®µДµзАліМ¶И
dЈ®ґЛИЬТєјУИлЙЩБїЗвСх»ЇДЖ»тСОЛбЈ¬ИЬТєµДpH±д»ЇІ»ґу
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРОпЦКµД·ЦЧУЦРјИУР¦ТјьЈ¬УЦУЦмьµДКЗЈЁ Ј© ўЩHClўЪH2OўЫN2ўЬH2O2ўЭC2H4ўЮC2H2 Ј®
A.ўЩўЪўЫ
B.ўЫўЬўЭўЮ
C.ўЩўЫўЮ
D.ўЫўЭўЮ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїКіЖ·МнјУјБдеЛбјШЈЁKBrO3Ј©»бЦВ°©Ј¬ТС±»ЅыУГЈ¬ЖдЦРдеФЄЛШЈЁBrЈ©µД»ЇєПјЫОЄЈЁЎЎЎЎЈ©
A.+1
B.©Ѓ2
C.+5
D.+3
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїЗїЛбИЬТєAУлЗїјоИЬТєBЈ¬ФЪіЈОВПВЖдpHЦ®єНОЄ15Ј¬µ±ЛьГЗ°ґТ»¶ЁМе»э±И»мєПК±Ј¬ИЬТєµДpHЗЎєГОЄ7Ј¬ФтAУлBµДМе»э±ИОЄ
A. 1 : 1 B. 2 : 1 C. 1 : 10 D. 10 : 1
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїіЈОВПВЈ¬0.1 mol/LµДH2C2O4ИЬТєЦРH2C2O4ЎўHC2O4-ЎўC2O42-ИэХЯЦРЛщХјОпЦКµДБї·ЦКэЈЁ·ЦІјПµКэЈ©ЛжpH±д»ЇµД№ШПµИзНјЛщКѕЎЈПВБР±нКцІ»ХэИ·µДКЗ
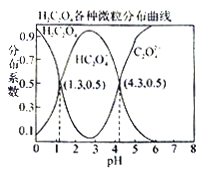
A. HC2O4-![]() H+Ј«C2O42-Ј¬KЈЅ1ЎБ10-4.3
H+Ј«C2O42-Ј¬KЈЅ1ЎБ10-4.3
B. Ѕ«µИОпЦКµДБїµДNaHC2O4ЎўNa2C2O4ИЬУЪЛ®ЦРЈ¬ЛщµГИЬТєpHЗЎєГОЄ4.3
C. іЈОВПВHFµДKЈЅ1ЎБ10-3.45Ј¬Ѕ«ЙЩБїH2C2O4ИЬТєјУИлµЅЧгБїNaFИЬТєЦРЈ¬·ўЙъµД·ґУ¦ОЄЈєH2C2O4+F-=HFЈ«HC2O4-
D. ФЪ0.1 mol/LNaHC2O4ИЬТєЦРЈ¬ёчАлЧУЕЁ¶ИґуРЎ№ШПµОЄЈєc(Na+)Јѕc(HC2O4-)Јѕc(H+)Јѕc(C2O42-)Јѕc(OH-)
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТ»¶ЁОВ¶ИПВЈ¬ФЪИЭ»эІ»±дµДГЬ±ХИЭЖчЦР·ўЙъИзПВ·ґУ¦ЈєI2(g) + H2(g)![]() 2HI(g)ЎЈёГ·ґУ¦ґпµЅЖЅєвЧґМ¬µД±кЦѕКЗЈЁ Ј©
2HI(g)ЎЈёГ·ґУ¦ґпµЅЖЅєвЧґМ¬µД±кЦѕКЗЈЁ Ј©
A. ИЭЖчЦРЖшМеµДСХЙ«І»ФЩёД±д
B. I2ЎўH2ЎўHIµД·ЦЧУКэЦ®±ИОЄ1ЎГ1ЎГ2
C. I2(g) єНH2(g)НкИ«ЧЄ»ЇОЄ HI(g)
D. µҐО»К±јдДЪЙъіЙn mol I2µДН¬К±ЙъіЙn mol H2
Ійїґґр°ёєНЅвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com