
| A. | CH4和 C3H8 | B. | CH4和C3H4 | C. | C2H2和C3H4 | D. | C2H4和C2H6 |
分析 2.24L该混合气体的物质的量为0.1mol,完全燃烧得到4.48L二氧化碳和3.6g水,生成二氧化碳的物质的量为0.2mol,水的物质的量为0.2mol,则混合气体平均分子式为C2H4,据此对各选项进行判断.
解答 解:n(混合烃)=n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol、n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,
即0.1mol该混合气体中含有0.2molC原子、0.4molH原子,
所以该烃的平均分子式为C2H4,
C原子数小于2的烃只有甲烷,所以另一种烃碳个数大于2且氢原子数等于4,可以是CH4、C3H4的混合物,
若碳个数均为2,则两种烃分子中氢原子个数一个大于4,另一个小于4,
A.CH4和C3H8混合,平均H原子数目介于4~8之间,不可能为4,故A错误;
B.CH4和C3H4按照1:1混合,平均分子式为C2H4,故B正确;
C.C2H2和C3H4混合,平均C原子数大于2,平均H原子数小于4,故C错误;
D.C2H4和C2H6混合,以任意比混合,平均C原子数目都是2,平均H原子数目介于4~6之间,不可能为4,故D错误;
故选B.
点评 本题考查混合物的计算、有机物分子式的确定,题目难度中等,关键是利用平均分子组成判断烃的组成,注意掌握质量守恒定律在确定有机物分子式中的应用,试题培养了学生的灵活应用能力.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | R的气态氢化物的水溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
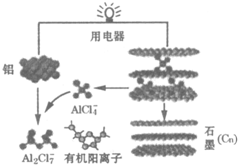
| A. | 放电时,有机阳离子向铝电极方向移动 | |
| B. | 充电时,铝电极连接外加电源的正极,石墨电极连接外加电源的负极 | |
| C. | 放电时负极的电极反应为:Al-3e-+7AlCl4-=4Al2Cl7- | |
| D. | 该电池的工作原理为:3Cn+4Al2Cl7-$?_{充电}^{放电}$3CnAlCl4+Al+AlCl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
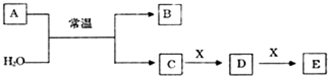
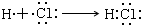 .
.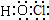 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
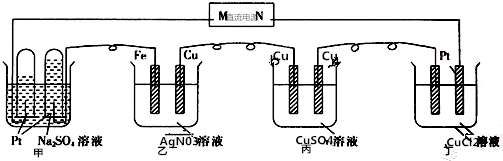
| A. | N为直流电源的正极 | |
| B. | 乙池的总反应为4AgN03+2H20═4Ag+4HNO3+O2↑ | |
| C. | 丙池的反应符合电解精炼铜原理 | |
| D. | 要使丁池电解质溶液复原,需加适量的CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
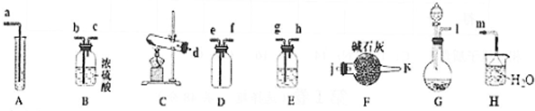
| 装置编号 | |||
| 装置中的试剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molN2的质量为28gmol-1 | |
| B. | 3.01×1023个SO2分子的质量为32g | |
| C. | Cl2的摩尔质量为71g | |
| D. | 标准状况下1mol任何物质的体积均为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com