
【题目】向20 mL 某浓度的AlCl3溶液中滴入2 mol·L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
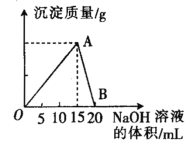
(1)图中A点表示的意义是______________。
(2)最大沉淀量是______________g。
(3)B点表示的意义是______________。
(4)所用AlCl3 溶液的物质的量浓度是______________。
(5)写出A~B段反应的离子方程式____________________________________
【答案】AlCl3与NaOH恰好完全反应,得到最大沉淀量 0.78 Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解 0.5mol/L Al(OH)3+OH-=AlO2-+2H2O
【解析】
NaOH溶液逐滴加入至AlCl3溶液中,开始时AlCl3和NaOH反应生成Al(OH)3沉淀,随着NaOH的继续滴入,Al(OH)3溶解生成NaAlO2,直至沉淀完全溶解,据此可分析解答问题。
(1)AlCl3和NaOH反应生成Al(OH)3沉淀,随着NaOH溶液的量逐渐增多,Al(OH)3量逐渐增大,到A点时NaOH将AlCl3恰好完全沉淀,故答案为:AlCl3与NaOH恰好完全反应,得到最大沉淀量;
(2)因为A→B消耗的NaOH溶液的体积为5mL,消耗NaOH的物质的量为0.005L×2mol/L=0.01mol,根据方程式Al(OH)3+NaOH=NaAlO2+2H2O可得,n[Al(OH)3]=0.01mol,
m[Al(OH)3]=0.01mol×78g/mol=0.78g,故答案为:0.78;
(3)随着NaOH的继续滴入,Al(OH)3溶解生成NaAlO2,B点表示Al(OH)3沉淀完全溶解,故答案为:Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解;
(4)根据铝原子守恒,则n(AlCl3)=n[Al(OH)3]=0.01mol,故氯化铝的物质的量浓度![]() ,故答案为0.5mol/L;
,故答案为0.5mol/L;
(5)A到B为Al(OH)3溶解生成NaAlO2,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O。


科目:高中化学 来源: 题型:
【题目】25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示。 下列说法正确的是

A.溶解度S(FeS)<S(ZnS)
B.a点表示FeS的不饱和溶液,且c(Fe2+)>c(S2﹣)
C.向b点对应溶液中加入Na2S溶液,可转化为c点对应的溶液
D.向含有Fe2+和Zn2+的溶液中滴加Na2S溶液,FeS先析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机高分子材料M的结构简式为 ,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。
,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。

已知:①A分子中有两种不同环境的氢原子
②CH3CH2CH![]() CH2
CH2![]() CH3CHBrCH
CH3CHBrCH![]() CH2
CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH
CH3CH![]() CHCHO+H2O
CHCHO+H2O
请回答以下问题:
(1)A的结构简式为____,B的名称为____,F中所含官能团的名称是__________。
(2)①和③的反应类型分别是____、____;反应②的反应条件为_____________。
(3)反应④的化学方程式为_____________________________________________。
(4)有机物E有多种同分异构体,其中同时符合下列条件的同分异构体有___种。
①属于芳香酯类 ②其酸性水解产物遇FeCl3显紫色
(5)以1-丙醇和NBS为原料可以制备聚丙烯醇(![]() )。请设计合成路线(其他无机原料任选)并用如下方式表示_____________________。
)。请设计合成路线(其他无机原料任选)并用如下方式表示_____________________。
A![]() B……
B……![]() 目标产物
目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列说法正确的是
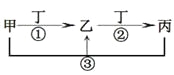
A.若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3
B.若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,则反应①的化学方程式4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C.若甲、乙、丙的溶液显碱性,丙可作为医疗上治疗胃酸过多症的药剂,将等物质的量的乙和丙溶于水形成混合溶液,溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)> c(H+)
D.若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,且原子序数依次增大;A的主族序数、周期数、原子序数均相同;B为非金属元素,其单质有多种同素异形体,其中一种可作电极材料;C是植物生长所需的主要元素之一;D和A可形成化合物![]() 和
和![]() ,且
,且![]() 是最常见的溶剂;E原子次外层电子数等于其它层电子数之和,则:
是最常见的溶剂;E原子次外层电子数等于其它层电子数之和,则:
![]() 的离子结构示意图为 ______ ,B、C、D、E与A形成的化合物中稳定性最强的是 ______
的离子结构示意图为 ______ ,B、C、D、E与A形成的化合物中稳定性最强的是 ______ ![]() 填化学式
填化学式![]() .
.
![]() 在加热和Cu作催化剂时,化合物
在加热和Cu作催化剂时,化合物![]() 与
与![]() 反应生成其中一种产物是
反应生成其中一种产物是![]() 的化学方程式为 ______ .
的化学方程式为 ______ .
![]() 五种元素中,含同一元素的各类物质能实现下列转化的有
五种元素中,含同一元素的各类物质能实现下列转化的有![]() 图
图![]() ______
______ ![]() 填元素符号
填元素符号![]()

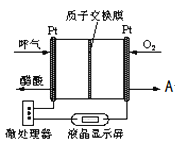
![]() 图所示是一种酸性燃料电池
图所示是一种酸性燃料电池![]() 检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应为 ______
检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应为 ______ ![]() 出口处的物质 ______ .
出口处的物质 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极 上析出6.4g某金属,下列说法正确的是

A.甲池是b极上析出金属银,乙池是c极上析出某金属
B.甲池是a极上析出金属银,乙池是d极上析出某金属
C.某盐溶液可能是CuSO4溶液
D.某盐溶液可能是Mg(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,a、b、d均为石墨电极,c为Mg电极,通电进行电解(电解液足量),下列说法正确的是
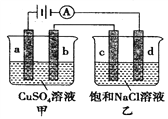
A. 向甲中加入适量Cu(OH)2,溶液组成可以恢复
B. 电解一段时间,乙溶液中会产生白色沉淀
C. 当b极增重3.2g时,d极产生的气体体积为1.12L
D. 甲中b极上的电极反应式为:4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照要求填写下列内容 :
(1)1molH2的质量是_________。
(2)已知0.5mol某气体分子的质量为16 g,则该气体的摩尔质量是_________。
(3)NA个氨气分子(NH3)中含_________mol原子。
(4)等质量的氧气和臭氧,它们原子的个数之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D原子序数依次增加,X、Y、Z、W是由这四种元素中的两种元素组成的常见化合物,X为有刺激性气味的气体,Y为淡黄色固体,甲是由C元素形成的气体单质,乙为红棕色气体,上述物质之间的转化关系如图所示![]() 部分反应物或生成物省略
部分反应物或生成物省略![]() 。下列说法不正确的是
。下列说法不正确的是

A.离子半径大小顺序:B>C>D>A
B.最简单气态氢化物的稳定性:B>C
C.图示转化关系涉及的反应均为氧化还原反应
D.元素C、D形成的化合物中一定含离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com