
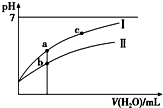
 已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( ) | CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
分析 A、酸的电离常数越大,则酸根离子的水解程度越小;
B、根据强酸制取弱酸判断,反应生成的应该为碳酸氢根离子;
C、$\frac{c({P}^{-})}{c(HP)•c(O{H}^{-})}$的分子、分母同时乘以氢离子浓度可得:$\frac{K(HP)}{{K}_{W}}$,温度不变,则该比值不变;
D、先根据电离程度大小判断醋酸、次氯酸对应曲线及起始浓度大小,a、b两点加入水的体积相同,则此时酸溶液浓度取决于酸的起始浓度.
解答 解:A、醋酸的电离常数大于次氯酸,所以醋酸的水解程度小于次氯酸,醋酸钠和次氯酸钠都是强碱弱酸盐,其混合溶液呈碱性,所以相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故A错误;
B、碳酸的二级电离小于次氯酸,所以碳酸氢根离子的酸性小于次氯酸,则向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O═HClO+HCO3-,故B错误;
C、在$\frac{c({P}^{-})}{c(HP)•c(O{H}^{-})}$的分子、分母同时乘以氢离子浓度可得:$\frac{K(HP)}{{K}_{W}}$,由于水的离子积和电离平衡常数只受温度影响,a、c的温度相同,则该比值相等,故C正确;
D、pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸性CH3COOH>HClO,所以a所在曲线表示CH3COOH,b所在曲线表示HClO,次氯酸的电离程度小于醋酸,所以醋酸的浓度减小,次氯酸的浓度较大,a、b两点相比,加入相同体积的水后仍然是次氯酸的浓度较大,即:图象中a点酸的浓度小于b点酸的浓度,故D错误.
故选C.
点评 本题考查电解质的强弱与电离常数的关系,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,明确酸的电离常数与酸的强弱、酸根离子水解能力的关系是解本题关键.


科目:高中化学 来源: 题型:解答题

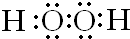 ,C元素在周期表中的位置是第二周期、第ⅦA族.
,C元素在周期表中的位置是第二周期、第ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷、丁烯 | B. | 乙炔、丙烷 | C. | 乙烷、乙烯 | D. | 乙炔、乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式  | B. | 氯化钠的分子式 NaCl | ||
| C. | 硫原子的最外层电子排布式3s23p4 | D. | 钠离子的结构示意图 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
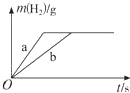
| A. | 曲线a为K,b为Na | |
| B. | 稀盐酸一定不足量 | |
| C. | 投入Na、K一定等质量 | |
| D. | 投入Na的物质的量小于K的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 4 | ⑧ | ⑨ | ⑩ |
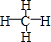 ;其中心原子采取sp3杂化,空间构型为正四面体.
;其中心原子采取sp3杂化,空间构型为正四面体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能和NaOH溶液反应 | |
| B. | 甲苯与液溴,铁作催化剂的反应 | |
| C. | 甲苯能被酸性高锰酸钾氧化 | |
| D. | 1mol邻二甲苯与3mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
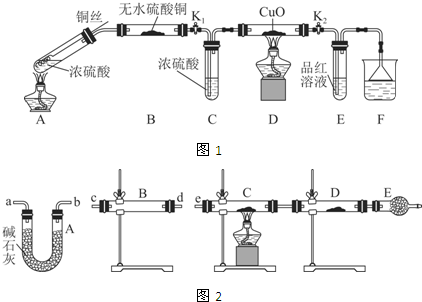
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ① | ② | ③ |
| C | CuO固体 | ④ | ⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com