
| A. | 锌粒与稀醋酸反应:Zn+2H+=Zn2++H2↑ | |
| B. | 常温下,用氢氧化钠溶液吸收多余的氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ | |
| D. | 氯化铝溶液与过量氨水反应:Al3++3OH-=Al(OH)3↓ |
分析 A.醋酸为弱酸,离子方程式中醋酸不能拆开,应该保留分子式;
B.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
C.漏掉了铜离子与氢氧根离子生成氢氧化铜沉淀的反应;
D.一水合氨为弱碱,一水合氨不能拆开,应该保留分子式.
解答 解:A.锌粒与稀醋酸反应生成醋酸锌和氢气,醋酸不能拆开,正确的离子方程式为:Zn+2CH3COOH=2CH3COO-+Zn2++H2↑,故A错误;
B.常温下,用氢氧化钠溶液吸收多余的氯气,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故B正确;
C.硫酸铜溶液与氢氧化钡反应生成硫酸钡和氢氧化铜沉淀,正确的离子方程式为:SO42-+Ba2++Cu2++2OH-=Cu(OH)2↓+BaSO4↓,故C错误;
D.氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵,一水合氨不能拆开,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:多选题
| A. | 该绿色食品中不含任何化学物质 | |
| B. | 用蒸馏法可从海水中获得淡水 | |
| C. | ag碳和bg氧气完全反应,一定生成(a+b)g的二氧化碳 | |
| D. | 用规格为10mL的量筒量取6.2mL的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧有浓烟 | |
| B. | 能使KMnO4酸性溶液褪色 | |
| C. | 能与溴发生1:2加成反应 | |
| D. | 与足量溴水反应,生成物中只有2个碳原子上有溴原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将CO2气体缓缓通入到含有等物质的量的KOH、Ba(OH)2和KAlO2的混合溶液中,直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示(假设每步反应均完全).下列关于整个反应进程中的各种描述不正确的是( )
将CO2气体缓缓通入到含有等物质的量的KOH、Ba(OH)2和KAlO2的混合溶液中,直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示(假设每步反应均完全).下列关于整个反应进程中的各种描述不正确的是( )| A. | d~e段沉淀的减少是由碳酸钡固体的消失所致 | |
| B. | b~c段反应的离子方程式是:2A1O2-+3H2O+CO2=2A1(OH)3↓+CO32- | |
| C. | 0~a段反应的化学方程式是:Ba(OH)2+CO2=BaCO3↓+H2O | |
| D. | a~b段与c~d段所发生的反应相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热蒸发皿时垫上石棉网 | B. | 将氢氧化钠固体放入烧杯中称量 | ||
| C. | 在量筒中溶解氯化钠固体 | D. | 将pH试纸浸入待测液中测定pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
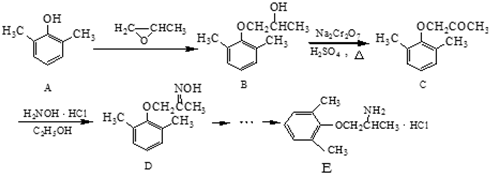
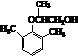 .
. .
.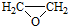 ).
).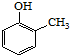 )和乙醇为原料制备
)和乙醇为原料制备 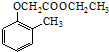 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
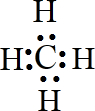 ,食醋中的有机物结构式
,食醋中的有机物结构式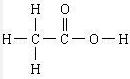 ,乙烯水化法所得产物的结构简式CH3CH2OH.
,乙烯水化法所得产物的结构简式CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com