
镁—次氯酸盐燃料电池的工作原理如图所示,该电池反应为 Mg+ClO-+H2O=Mg(OH)2+Cl-下列有关说法正确的是 ( )
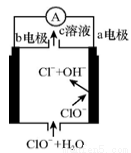
A.电池工作时,c溶液中的溶质是MgCl2
B.电池工作时,正极a附近的pH将不断增大
C.负极反应式:ClO--2e-+H2O=Cl-+2OH-
D.b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl-
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源:2015-2016学年河北省高一6月月考化学试卷(解析版) 题型:选择题
实验室用100mL 1mol·L—1盐酸与锌粉反应制备氢气,下列措施能加快反应速率的是
A.改用300mL 1 mol·L—1盐酸
B.降低温度
C.用锌粒代替锌粉
D.滴加少量CuCl2溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西宾阳县宾阳中学高一5月月考化学试卷(解析版) 题型:填空题
(i)现有下列5种有机物:
①CH≡CH ②CH3CH2OH ③
④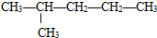 ⑤
⑤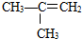 ⑥ HOCH2CH2CH2COOH
⑥ HOCH2CH2CH2COOH
(1) 其中,属于烃的衍生物是 _____________(填序号,下同);
(2) 因反应使溴的四氯化碳溶液褪色的是_____________;
(3) 所有原子在同一条线上的是_____________;
(4) ⑥能自身发生反应生成五元环化合物,该反应的反应类型是____________。
(ii)酯化反应是重要的有机化学反应之一。甲同学为了研究该反应机理使用了 “CH3CH218OH”和乙酸做该实验,结果含18O原子的产物的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西宾阳县宾阳中学高一5月月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.甲烷分子的空间构型是正四面体,所以CH2Cl2有两种不同的结构
B.含有C、H元素的物质就是有机物,所有的有机物都可以燃烧
C.任何烷烃分子都不可能为平面结构
D. 易溶于汽油、酒精、苯等有机溶剂的物质都是有机化合物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西宾阳县宾阳中学高二5月月考化学试卷(解析版) 题型:选择题
根据以下两幅图,可判断出下列离子方程式中错误的是( )

A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)=2Ag(s)+Cd2+(aq)
D.2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西宾阳县宾阳中学高二5月月考化学试卷(解析版) 题型:选择题
HA、H2B是两种弱酸,H2B+A-=HB-+HA, B2-+HA=HB-+A-则下列说法正确的是 ( )
A.H2B的电离方程式为:H2B 2H+ + B2-
2H+ + B2-
B.结合质子能力由强到弱的顺序为:B2->A->HB-
C.等物质的量浓度NaA、NaHB、Na2B三种盐的水溶液,NaA碱性最强
D.等pH的HA、H2B两种溶液中,水的电离出的氢离子前者大于后者
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一下第二次月考化学试卷(解析版) 题型:填空题
(1)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为 _ 。
(2)已知CH4(g)+2O2(g)== CO2(g)+2H2O(l);ΔH=-Q1kJ·mol-1 ,
 =2H2O(g);△H2=-Q2 kJ·
=2H2O(g);△H2=-Q2 kJ· ,
,
 =2H2O(l);△H2=-Q3 kJ·
=2H2O(l);△H2=-Q3 kJ· 。
。
常温下,取体积比4∶1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为 kJ。
(3)已知,在101kPa时,H2与1.00mol O2完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学反应方程式为___________ _ 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一下第二次月考化学试卷(解析版) 题型:选择题
如果发现了原子序数为116的元素,下列对它的叙述中正确的是( )
①位于第7周期
②非金属元素
③最外电子层有6个电子
④没有放射性
⑤属于氧族元素
⑥属于锕系元素
A.①③⑤ B.②④⑥ C.①③⑥ D.③④⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下学期期中考试化学试卷(解析版) 题型:填空题
Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?
(1)夏天的食品易变霉,在冬天不易发生该现象 ;
(2)同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢 ;
(3)MnO2加入双氧水中放出气泡更快 .
Ⅱ:在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
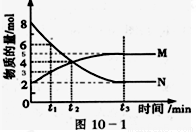
(1)比较t2时刻,正逆反应速率大小V正 V逆.(填“>”、“=”、“<”)
(2)若t2=2min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为: .
(3)t3时刻化学反应达到平衡,反应物的转化率为 .
(4)如果升高温度,则V逆 (填增大、减小或不变).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com