
| 元素代号 | A | B | D | E | F | G | I | J |
| 化合价 | +1 | -2 | +5、-3 | +4、-4 | +7、-1 | +3 | +2 | +1 |
| 原子半/nm | 0.037 | 0.074 | 0.075 | 0.077 | 0.099 | 0.143 | 0.160 | 0.186 |
| A. | A、B组成的化合物与A、E组成的化合物中均可能含有非极性共价键 | |
| B. | 离子半径由大到小顺序是F>D>B>J>G | |
| C. | B、J组成的化合物一定属于离子化合物,它与水的反应可能是氧化还原反应 | |
| D. | 工业上生产G、I、J的单质均是通过电解它们的熔融氯化物实现的 |
分析 B的化合价为-2,没有正化合价,则B为O元素;D的化合价为+5、-3,则D位于ⅤA族,结合原子半径稍D大于B,则D为N元素;E的化合价为+4、-4,则E位于ⅣA族,E的原子半径稍大于B,则E为C元素;F的化合价为+7、-1,其原子半径大于B,则F为Cl元素;G、I、J化合价分别为+3、+2、+1,三者的原子半径逐渐增大,则三种元素位于第三周期,分别为Al、Mg、Na元素;A的化合价为+1,且A的原子半径需要B,则A为H元素,据此结合元素周期律的知识进行解答.
解答 解:B的化合价为-2,没有正化合价,则B为O元素;D的化合价为+5、-3,则D位于ⅤA族,结合原子半径稍D大于B,则D为N元素;E的化合价为+4、-4,则E位于ⅣA族,E的原子半径稍大于B,则E为C元素;F的化合价为+7、-1,其原子半径大于B,则F为Cl元素;G、I、J化合价分别为+3、+2、+1,三者的原子半径逐渐增大,则三种元素位于第三周期,分别为Al、Mg、Na元素;A的化合价为+1,且A的原子半径需要B,则A为H元素,
A.A、B、E分别为H、O、H元素,A、B组成的化合物双氧水,A、E组成的化合物乙烷、丙烷等含有多个C的烃类有机物中均可能含有非极性共价键,故A正确;
B.离子的电子层越多,离子半径越大,电子层相同时,离子的核电荷数越大,离子半径越小,则Cl->N3->C4+>O2->Na+>Al3+,即F>D>B>J>G,故B正确;
C.B、J分别为O、Na元素,二者形成的化合物有氧化钠、过氧化钠,二者都是离子化合物,其中过氧化钠能够与水发生氧化还原反应,故C正确;
D.G、I、J分别为Al、Mg、Na元素,工业上可电解氯化钠、氯化镁获得钠、镁单质,但是氯化铝为共价化合物,熔融状态下不导电,工业上通过电解熔融氧化铝的方法获得铝,故D错误;
故选D.
点评 本题考查了原子结构与元素周期律的应用,题目难度中等,根据表中数据正确推断各元素名称为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 待提纯的物质 | 选用试剂 | 操作的方法 |
| A | FeCl2溶液(FeCl3溶液) | 铁粉 | 过滤 |
| B | Al2O3(Fe2O3) | NaOH溶液和CO2 | 溶解、过滤、过滤 |
| C | Cl2(HCl) | 饱和食盐水 | 洗气 |
| D | Fe(OH)3胶体(NaCl溶液) | 水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知各种金属离子完全沉淀的pH如下表:
已知各种金属离子完全沉淀的pH如下表:| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
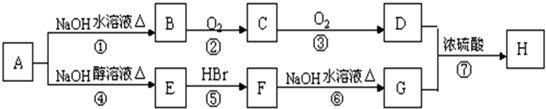
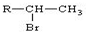 (R为烃基)
(R为烃基)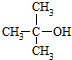 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
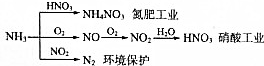
| A. | NH4NO3是常用化肥,在农业上用作棉花、亚麻、大麻、烟草和蔬菜等农作物的肥料,效果特别好 | |
| B. | 硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5 | |
| C. | NH3和NO2在一定条件下发生氧化还原反应,其化学方程式:8NH3+6NO2$\frac{\underline{催化剂}}{△}$7N2+12H20 | |
| D. | NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
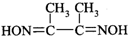 是检验Ni2+的灵敏试剂.
是检验Ni2+的灵敏试剂.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ |
| 仪器装置 | 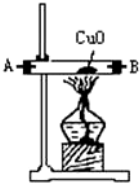 | 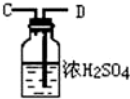 | 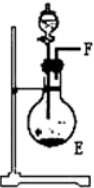 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
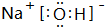 ,CB2的电子式为
,CB2的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
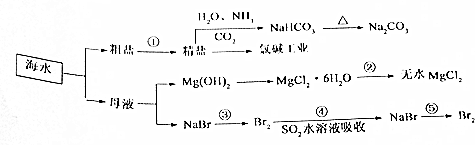
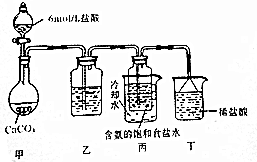
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com