
| A. | 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 氯气长时间放置后酸性减弱 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
分析 氯气通入溶液中,与水反应发生Cl2+H2O═HCl+HClO,氯水中存在Cl2、H2O、HClO、H+、Cl-、ClO-、OH-,利用离子、分子的性质来分析.
解答 解:A.次氯酸有强氧化性能使有色布条褪色,向氯水中加入有色布条,一会儿有色布条褪色,说明溶液中有HClO存在,故A错误;
B.氯气与水反应生成盐酸和次氯酸,盐酸电离产生氢离子使溶液显酸性,次氯酸具有漂白性,所以试纸先变红色后褪色,故B正确;
C.氯气长时间放置,最终生成HCl,溶液酸性增强,故C错误;
D.Cl2+H2O?HCl+HClO,该反应是可逆反应,向氯水中加入氢氧化钠溶液,氯水黄绿色消失,说明氯水溶液呈酸性,不能证明含有次氯酸,故D错误.
故选B.
点评 本题考查了氯水的性质,为高频考点,难度不大,明确氯水中存在的微粒是 解本题的关键,根据氯水中各种微粒的性质来解答即可.


科目:高中化学 来源: 题型:选择题
| A. | 用过量的氨水吸收二氧化硫:2NH3•H2O+SO2═2NH4++SO${\;}_{3}^{2-}$?+H2O | |
| B. | Al(OH)3沉淀中滴加盐酸 Al(OH)3+3H+═Al3++3H2O | |
| C. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | 碳酸氢钠溶液中滴加氢氧化钠:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Al3+、Cl- | B. | Na+、K+、Cl-、SO42- | ||
| C. | HCO3-、Na+、Cl-、K+ | D. | I-、Fe2+、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M+ | B. | HA- | C. | A2- | D. | M+和HA- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Al溶于稀硝酸中:2Al+6H+═2Al3++3H2↑ | |
| B. | CuH在足量C12中燃烧:2CuH+2Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+H2 | |
| C. | 向复盐NH4Al(S04)2溶液中加入Ba(0H)2至沉淀质量最大:NH4++Al3++4OH-+2SO42-═NH3•H2O+Al(OH)3↓+2BaSO4↓ | |
| D. | 向饱和NaHSO3溶液中加入FeC13溶液:S032-+2Fe3++H20═S042-+2Fe2++2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=7,溶液一定显中性 | |
| B. | 当溶液c(H+)=c(OH-)时,溶液显中性 | |
| C. | 正盐溶液一定显中性,酸性盐溶液可能显酸性或碱性 | |
| D. | 当溶液显酸性时,水电离的c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
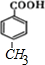 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在实验条件许可的情况下,实验室也可以进行某些有机物的制备.实验室制备溴乙烷(C2H5Br)的装置和步骤如下(已知溴乙烷的沸点38.4℃,密度比水大,难溶于水):
在实验条件许可的情况下,实验室也可以进行某些有机物的制备.实验室制备溴乙烷(C2H5Br)的装置和步骤如下(已知溴乙烷的沸点38.4℃,密度比水大,难溶于水):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com