

分析 (1)天然磁石成分为四氧化三铁;
(2)①Ⅰ.Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)△H1═+19.3kJ•mol-1
Ⅱ.3FeO(s)+H2O(g)?Fe3O4(s)+H2(g)△H2═-57.2kJ•mol-1
Ⅲ.C(s)+CO2(g)?2CO(g)△H3═+172.4kJ•mol-1
依据盖斯定律计算Ⅰ+Ⅱ+Ⅲ得到铁氧化物循环裂解水制氢气总反应的热化学方程式;
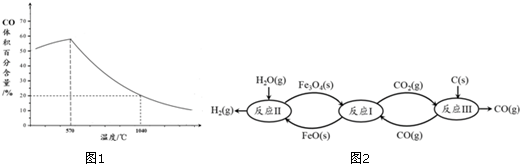
②i.图象分析可知,随温度升高CO体积分数增大,说明达到平衡状态后,升温平衡逆向进行,正反应为放热反应;
ii.高于570°C,随温度升高,反应Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)平衡正向进行,平衡常数的变化趋势增大,结合三行计算列式计算得到平衡浓度,平衡常数K=$\frac{生成物平衡难度幂次方乘积}{反应物平衡难度幂次方乘积}$;
(3)①[Fe(CN)6]4-和Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀;
②若试纸变蓝则证明食品中含有CN-,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4- 与Fe3+反应生成普鲁士蓝使试纸显蓝色.
解答 解:(1)古代中国四大发明之一的司南是由天然磁石制成的,磁铁成分主要是四氧化三铁,选c,
故答案为:c;
(2)①Ⅰ.Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)△H1═+19.3kJ•mol-1
Ⅱ.3FeO(s)+H2O(g)?Fe3O4(s)+H2(g)△H2═-57.2kJ•mol-1
Ⅲ.C(s)+CO2(g)?2CO(g)△H3═+172.4kJ•mol-1
依据盖斯定律计算Ⅰ+Ⅱ+Ⅲ得到铁氧化物循环裂解水制氢气总反应的热化学方程式;C(s)+H2O(g)═H2(g)+CO(g)△H═+134.5 kJ•mol-1 ,
故答案为:C(s)+H2O(g)═H2(g)+CO(g)△H═+134.5 kJ•mol-1 ;
②i.当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行,图象分析可知,随温度升高CO体积分数增大,说明达到平衡状态后,升温平衡逆向进行,正反应为放热反应,△H<0,
故答案为:<;当其他条件一定时,温度升高,CO的体积百分含量增大,可逆反应Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g) 逆向移动,故△H<0;
ii.高于570°C,随温度升高,反应Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)平衡正向进行,平衡常数的变化趋势增大,1040℃时CO体积分数为20%,结合三行计算列式计算得到平衡浓度,设起始浓度CO为1mol/L,消耗CO浓度为x
Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)
起始量(mol/L) 1 0
变化量(mol/L) x x
平衡量(mol/L) 1-x x
$\frac{1-x}{1}$=20%
x=0.8mol/L
K=$\frac{0.8}{1-0.8}$=4,
故答案为:增大; 4;
(3)①[Fe(CN)6]4-和Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀,反应的离子方程式为:3[Fe(CN)6]4-+4Fe3+═Fe4[Fe(CN)6]3↓,
故答案为:3[Fe(CN)6]4-+4Fe3+═Fe4[Fe(CN)6]3↓;
②基于普鲁士蓝合成原理可检测食品中CN-,碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4- 与Fe3+反应生成普鲁士蓝使试纸显蓝色,
故答案为:碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4- 与Fe3+反应生成普鲁士蓝使试纸显蓝色.
点评 本题考查了物质性质、热化学方程式书写、离子检验实验设计方案分析判断、化学平衡计算等知识点,注意题干信息的理解应用,题目难度中等.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
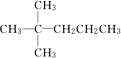 ,该烷烃分子的名称2,2-二甲基戊烷C7H16另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称3,3-二甲基-1-戊烯.
,该烷烃分子的名称2,2-二甲基戊烷C7H16另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称3,3-二甲基-1-戊烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
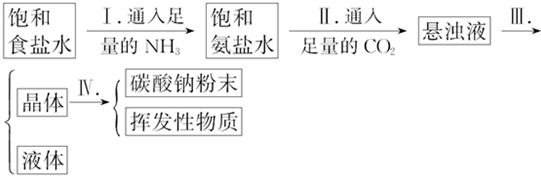
| 温度 盐的溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
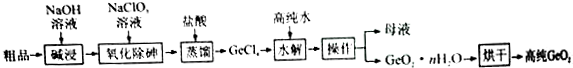
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀溶液中,1mol酸和1mol碱完全反应所放出的热量叫做中和热 | |
| B. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 | |
| C. | 热化学方程式中,各物质前的化学计量数不表示分子个数 | |
| D. | 如果反应物所具有的总能量低于生成物所具有的总能量,则发生的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
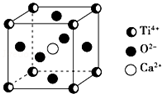 CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )| A. | CaTiO3的摩尔质量为236 | |
| B. | CaTiO3晶体中每个Ti4+与12个Ca2+紧相邻 | |
| C. | CaTiO3晶体中每个Ti4+与12个O2-紧相邻 | |
| D. | CaTiO3晶体中每个Ti4+与12个Ti4+紧相邻 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com