
煤是重要的能源,也是化工生产的重要原料。
(1)煤燃烧产生的废气直接排放到空气中,可能导致的环境污染问题是_______。
(2)下图是对煤矿燃烧产生的废气进行常温脱硫处理的流程示意图。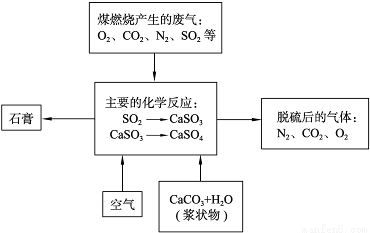
①废气脱硫过程中,主要反应的化学方程式为______________、_____________;
②在煤矿中直接添加一种物质,可有效减少煤矿燃烧产生的SO2,该物质是___;
③石膏的工业生产中的用途是_________________(写出一种用途即可)。
(3)煤经过___________(填加工方法)可以得到焦炉煤气、煤矿焦油和焦炭。煤焦油经过_______(填加工方法)可得到芳得族化合物。煤矿也可以用氢化法转化燃油,氢化法的本质是______________。
(4)煤可以液化转化为CH3OH,有人设计出在KOH溶液中用电极表面镀一层细小的铂粉做电极,铂吸附气体的能力强,性质稳定,利用CH3OH和O2构成的燃料电池的能量转化主要形式是 ,负极反应式为 ,电极表面镀铂粉的原因为 。
(1)酸雨、粉尘污染
(2)①SO2+CaCO3 CaSO3+CO2、2CaSO3+O2=2CaSO4
②CaCO3、CaO、Ca(OH)2
③医用、建筑材料、模型等合理答案
(3)干馏;分馏;增加煤中氢元素得含量,提高氢原子数与碳原子数的比值
(4)由化学能转化为电能;CH3OH+8OH- -6e-=CO32-+6H2O;增大电极单位面积吸附CH3OH、O2分子数,加速电极反应速率。
【解析】(1)煤炭燃烧会产生二氧化硫,能产生酸雨,同时煤尘也对环境有污染作用。
(2)石灰石和空气进行脱硫工艺是,石灰石与二氧化硫反应生成亚硫酸钙和二氧化碳,亚硫酸钙继续氧化生成硫酸钙。①SO2+CaCO3 CaSO3+CO2、2CaSO3+O2=2CaSO4。二氧化硫是酸性氧化物,均与CaO、Ca(OH)2、CaCO3反应,产物均能生成石膏。②CaCO3或Ca(OH)2或CaO。③石膏可以用做医用、建筑材料、模型等。
(3)煤可以经过煤的干馏得到煤焦油、炉气和焦炭。煤焦油通过蒸馏得到芳香族化合物;煤中不含氢元素,可以通过加氢转化为燃油,其本质是增加煤中氢元素得含量,提高氢原子与碳原子数的比值。
(4)原电池的原理是化学能转化为电能。负极发生氧化反应,甲醇从负极通入,因而电极反应式是,CH3OH+8OH- -6e-=CO32-+6H2O。电极表面镀上一层铂粉,以增大电极单位面积吸附CH3OH、O2分子数,加速电极反应速率。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015安徽望江中学同步练(人教选修4)2.3化学平衡状态的建立及标志(解析版) 题型:选择题
在密闭容器中进行如下反应:X2(g)+3Y2(g)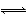 2Z(g),X2、Y2、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不正确的是( )
2Z(g),X2、Y2、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不正确的是( )
A.X2为0.3 mol·L-1,Y2为0.9 mol·L-1
B.Y2为1.0 mol·L-1
C.X2为0.3 mol·L-1,Z为0.2 mol·L-1
D.Z为1.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学钠及其化合物主要性质(解析版) 题型:选择题
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是
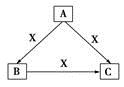
A.若X为Cl2,则C可为FeCl3
B.若X为KOH溶液,则A可为AlCl3
C.若X为O2,则A可为硫化氢
D.若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学速率表示与平衡移动(解析版) 题型:选择题
高温下,某反应达平衡,化学平衡常数表达式为: ,恒容时,温度升高H2浓度减小。下列说法正确的是
,恒容时,温度升高H2浓度减小。下列说法正确的是
A.该反应化学方程式为:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
B.恒温恒容下,反应达平衡时,再通入一定量的CO2,CO的体积分数一定增大
C.升高温度,正反应速率增大,逆反应速率减小
D.该反应的焓变为正值
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习5(解析版) 题型:填空题
氧元素与多种元素具有亲和力,所形成化合物的种类仅次于碳元素。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为 ,氧元素与氟元素能形成OF2分子,该分子的空间构型为 。
(2)根据等电子原理,判断NO2+离子中,氮原子轨道的杂化类型为 ,1molO22+所含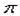 键的数目为 。
键的数目为 。
(3)氧元素与过渡元素可以形成多种价态的金属氧化物。如铬可生成Cr2O3、CrO3等,试写出Cr3+核外电子排式 。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:
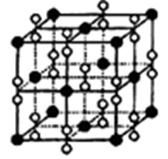
由此可判断该钙的氧化物的化学式为 。已知晶胞边长为540pm,则该氧化物的密度是 g·cm-3。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习4(解析版) 题型:填空题
避蚊酯(DMP)是一种塑化剂.相对分子质量为194,摄人后对人体有一定的危害,其结构可表示为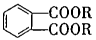 (其中R为烃基)实验室由以下方法可得到DMP
(其中R为烃基)实验室由以下方法可得到DMP
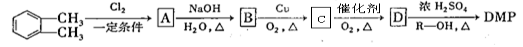
请回答:
(1)物质C中官能团的名称为 。
(2)下列有关DMP的说法可能正确的是 。(填字母标号)
A.DMP的分子式为C10H12O4
B.DMP可以发生取代、加成、氧化等反应
C.DMP在水中的溶解度不大
(3)B与乙二酸(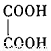 )在一定条件下可以按物质的量1:1发生反应生成高分子化合物,该高分子化合物的结构简式为 。
)在一定条件下可以按物质的量1:1发生反应生成高分子化合物,该高分子化合物的结构简式为 。
(4)工业上以邻二甲苯(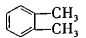 )为原料先生产苯酐(
)为原料先生产苯酐(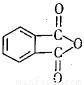 ),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为 。
),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为 。
(5)芳香化合物E与C互为同分异构体,若lmo E与足量银氨溶液反应最多生成2mol Ag,则E可能的结构简式为 。B也存在多种同分异构体,符合下列条件的B的同分异构体有 种。
①l mol有机物可以与2mol NaOH反应
②苯环上的一氯代物只有一种。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。

如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是 (填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠 g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 g(保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。
石灰—石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为:SO2+Ca(OH)2=CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O=2CaSO4·2H2O。其流程如下图:
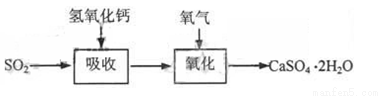
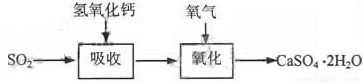
碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
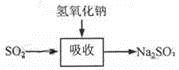
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 。和碱法相比,石灰-石膏法的优点是 ,缺点是 。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习1(解析版) 题型:填空题
聚酰胺—66常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线合成: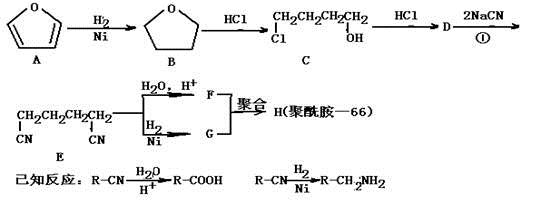
(1)能与银氨溶液反应的B的同分异构体的结构简式为 ,
(2)D的结构简式为 ,①的反应类型为 ,
(3)为检验D中的官能团,所用试剂包括NaOH水溶液及 ,
(4)由F和G生成H的反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子方程式正误判断(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com