
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.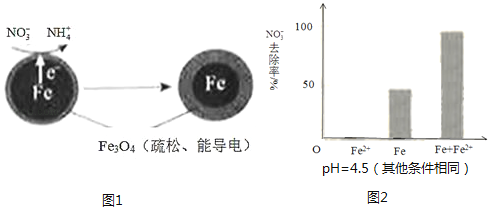
(1)Fe还原水体中NO3﹣的反应原理如图1所示.
①作负极的物质是 .
②正极的电极反应式是 .
(2)将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: .
(4)其他条件与(2)相同,经1小时测定NO3﹣的去除率和pH,结果如表:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因: .
【答案】
(1)铁;NO3﹣+8e﹣+7H2O=NH4++10OH﹣
(2)pH越高,Fe3+越易水解生成FeO(OH),FeO(OH)不导电,所以NO3﹣的去除率低
(3)Ⅱ;Fe2++2FeO(OH)=Fe3O4+2H+ , 加入Fe2+之所以可以提高硝酸根离子的转化率主要因为减少了FeO(OH)的生成,增强了导电性,另外生成了H+ , H+浓度增大,pH减小,使NO3﹣的转化率增大
(4)由于Fe3+的水解,所以pH越高,Fe3+越容易生成FeO(OH),FeO(OH)又不导电,所以NO3﹣的去除率越低
【解析】解:(1)①Fe还原水体中NO3﹣ , 则Fe作还原剂,失去电子,作负极,
故答案为:铁;
②NO3﹣在正极得电子发生还原反应产生NH4+ , 根据电荷守恒写出离子方程式:NO3﹣+8e﹣+7H2O=NH4++10OH﹣ ,
故答案为:NO3﹣+8e﹣+7H2O=NH4++10OH﹣;
(2)pH越高,Fe3+越易水解生成FeO(OH),FeO(OH)不导电,所以NO3﹣的去除率低,
故答案为:pH越高,Fe3+越易水解生成FeO(OH),FeO(OH)不导电,所以NO3﹣的去除率低;
(3)①从右图可以看出只加入铁粉和只加入Fe2+ , NO3﹣的去除率都不及同时加入铁和亚铁离子时NO3﹣的去除率高,说明不是应用了亚铁离子的还原性提高硝酸根的去除率,而是由于Fe2+破坏FeO(OH)氧化层,
故答案为:Ⅱ;
②同位素示踪法证实了Fe2+能与FeO(OH)反应生成Fe3O4 , 离子方程式为:Fe2++2FeO(OH)=Fe3O4+2H+ , 加入Fe2+之所以可以提高硝酸根离子的转化率主要因为减少了FeO(OH)的生成,增强了导电性,另外生成了H+ , H+浓度增大,pH减小,使NO3﹣的转化率增大,
故答案为:Fe2++2FeO(OH)=Fe3O4+2H+ , 加入Fe2+之所以可以提高硝酸根离子的转化率主要因为减少了FeO(OH)的生成,增强了导电性,另外生成了H+ , H+浓度增大,pH减小,使NO3﹣的转化率增大;
(4)由于Fe3+的水解,所以pH越高,Fe3+越容易生成FeO(OH),FeO(OH)又不导电,所以NO3﹣的去除率越低,
故答案为:由于Fe3+的水解,所以pH越高,Fe3+越容易生成FeO(OH),FeO(OH)又不导电,所以NO3﹣的去除率越低.
(1)①Fe还原水体中NO3﹣ , 则Fe作还原剂,失去电子,作负极;②NO3﹣在正极得电子发生还原反应产生NH4+;
(2)pH越高,Fe3+越易水解生成FeO(OH),FeO(OH)不导电,所以NO3﹣的去除率低;
(3)①从右图可以看出只加入铁粉和只加入Fe2+ , NO3﹣的去除率都不及同时加入铁和亚铁离子时NO3﹣的去除率高,说明不是应用了亚铁离子的还原性提高硝酸根的去除率;②同位素示踪法证实了Fe2+能与FeO(OH)反应生成Fe3O4 , 离子方程式为:Fe2++2FeO(OH)=Fe3O4+2H+ , 既减少了FeO(OH)的生成,增强了导电性,又生成了H+ , H+浓度增大,pH减小,使NO3﹣的转化率增大;
(4)由于Fe3+的水解,所以pH越高,Fe3+越容易生成FeO(OH),FeO(OH)又不导电,所以NO3﹣的去除率越低.考查化学反应原理,涉及到的知识有电化学、氧化还原反应等,题中的Fe与NO3﹣的反应跟溶液酸碱性有关,抓住这一点是解题的关键,第Ⅱ问的解答有一定的难度,特别是阐述上的准确性.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】将a、b、c、d 4种金属两两连接浸入电解质溶液中,组成4个原电池(如图):
①中a极发生氧化反应 ②中电流由b到c ③中c极质量增加 ④中a极有大量气泡,则4种金属的活泼性由强到弱的顺序为( )
A.d>a>c>b
B.b>d>c>a
C.d>c>a>b
D.a>d>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有氯气的三个集气瓶中,分别注入约五分之一的下列液体并振荡,观察如图所记录的现象,判断各瓶注入的液体依次是什么.( )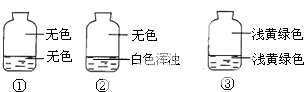
A.AgNO3溶液、NaOH溶液、水
B.NaOH溶液、AgNO3溶液、水
C.水、AgNO3溶液、NaOH溶液
D.AgNO3溶液、水、NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一.研究钢铁的腐蚀及防护有重要意义.回答下列问题:
(1)钢铁发生腐蚀的主要类型是电化学腐蚀,在电化学腐蚀中,负极反应是 , 正极反应是 .
(2)某实验小组设计图1实验探究铁生锈的条件: 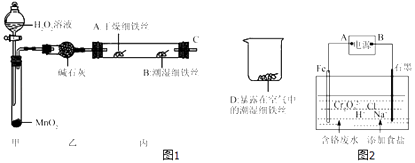
反应4min后观察,发现A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮.该实验说明铁生锈主要与和有关;B、D处实验现象对比说明:决定铁生锈的一个重要因素是 .
(3)金属及塑料制品表面镀铬不仅美观还可提高金属制品抗腐蚀性能.常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成.
①重铬酸中,Cr元素的化合价为 .
②镀铬时由CrO42﹣放电产生铬镀层.阴极的电极反应式为 .
(4)电镀废水中Cr2O72﹣具有高毒性,必须经处理后才能排放.电解法处理含铬的强酸性废水的原理如图2所示.
电解产生的Fe2+将Cr2O72﹣还原为Cr3+ , 再随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成.
①图中A为电源极;电解时阴极产生的气体为(写化学式).
②写出Fe2+与Cr2O72﹣反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是。
(2)已知,Ksp=(AgCl)=1.8×10-10 , 若向50mL0.018mol/L的AgNO3溶液中加入50mL0.020mol/L的盐酸,混合后溶液中的Ag+的浓度为 mol/L,pH为 。
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。
(4)右图所示原电池正极的反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂﹣KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是
①在外电路中,电子由铜电极流向银电极
②正极反应为:Ag++e﹣=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同( )
A.①②
B.①②④
C.②③
D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂﹣KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是
①在外电路中,电子由铜电极流向银电极
②正极反应为:Ag++e﹣=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同( )
A.①②
B.①②④
C.②③
D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com