
分析 (1)H2O2与亚铁离子反应生成三价铁离子;
(2)氢氟酸能与玻璃及陶瓷中的二氧化硅反应;
(3)氢氧化钠与三价铁离子反应生成氢氧化铁,再加HF,生成FeF3和水;
(4)HF属于有毒的气体,则制备三氟化铁时应在通风橱中进行;
(5)三氟化铁与Li发生置换反应生成Fe和LiF;
(6)根据C12的物质的量求出亚铁离子的物质的量,根据氧化铁的质量求出Fe元素的总物质的量,n(Fe)-n(Fe2+)=n(Fe3+),由亚铁离子与铁离子的物质的量之比求出铁氧体中FeO与Fe2O3的个数比,据此确定铁氧体的化学式.
解答 解:(1)固体铁氧体磁性材料溶于过量盐酸,所得溶液中含有亚铁离子,接着加入H2O2,H2O2与亚铁离子反应生成三价铁离子,其反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,
故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(2)步骤②将沉淀加入反应瓶中,加入过量的氢氟酸溶液反应,由于氢氟酸能与玻璃及陶瓷中的二氧化硅反应,所以反应瓶材质应该为聚四氟乙烯,
故答案为:C;
(3)氢氧化钠与三价铁离子反应生成氢氧化铁,再加HF,生成FeF3和水,则加氢氟酸反生反应的化学方程式为Fe(OH)3+3HF=FeF3+3H2O,
故答案为:Fe(OH)3+3HF=FeF3+3H2O;
(4)HF属于有毒的气体,为了防止中毒,则制备三氟化铁时应在通风橱中进行,故答案为:通风橱;
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应生成Fe和LiF,该电池反应的化学方程式为FeF3+3Li=Fe+3LiF,故答案为:FeF3+3Li=Fe+3LiF;
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672mL C12,则氯气的物质的量为0.03mol,
由2Fe2++Cl2=2Fe3++2Cl-,可知Fe2+为0.06mol,则原铁氧体样品中n(FeO)=0.06mol,
把溶液蒸干,灼烧至恒重得9.6g固体为Fe2O3,则n(Fe2O3)=$\frac{9.6g}{160g/mol}$=0.06mol,则原来溶液中Fe元素共0.06×2=0.12mol,
所以原来溶液中n(Fe3+)=n(Fe)-n(Fe2+)=0.12mol-0.06mol=0.06mol,则原铁氧体样品中n(Fe2O3)=0.06mol×$\frac{1}{2}$=0.03,
所以原铁氧体样品中n(FeO):n(Fe2O3)=0.06mol:0.03mol=2:1,故铁氧体的化学式为2FeO•Fe2O3或Fe4O5;
故答案为:2FeO•Fe2O3或Fe4O5.
点评 本题考查了物质制备方案的设计实验,涉及氧化还原反应、方程式的书写、物质的量的有关计算、元素化合物的性质等,题目侧重于考查学生对基础知识的综合应用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
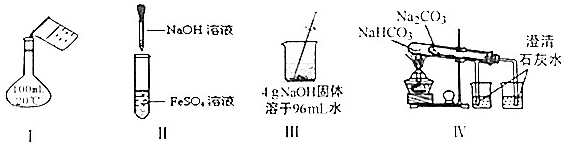
| A. | 实验Ⅰ:配制150mL0.10mol/L盐酸 | B. | 实验II:制取Fe(OH)2 | ||
| C. | 实验Ⅲ:配制4%NaOH溶液 | D. | 实验Ⅳ:比较两种物质的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA | |
| B. | 常温常压下,16g14CH4所含中子数目为8NA | |
| C. | 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA | |
| D. | 标准状况下,2.24 L己烷含有分子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精灯不慎碰到起火,立马用大量水泼灭 | |
| B. | 浓碱液溅到皮肤上,用较多水冲洗,然后涂上硼酸溶液 | |
| C. | 实验结束后将剩余的K和Na不能放回原试剂瓶 | |
| D. | 加热液体的试管口能正对着自己或别人 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 | B. | 0.05 | C. | K${\;}_{a1}^{θ}$(H2S) | D. | K${\;}_{{a}_{2}}^{θ}$(H2S) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com