
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。(1)下列叙述正确的是 。(填字母)
A.CH2O与水分子间能形成氢键 B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个 键和1个大
键和1个大 键,C6H6是非极性分子
键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
|
元 素 |
Mn |
Fe |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
Mn元素价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。
(4)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为 。已知晶胞边长为bcm,阿伏伽德罗常数为NA该氧化物的密度为__________________g/cm-3

(5)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为 。
②与CNO-互为等电子体微粒的化学式为 (写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
(1)AD (2)3d54s2 Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态。)(3)d区
(4) TiO2 160/( NA·b3) .(5)① H<C<N<O ②CO2(N2O)、SCN ③ N≡C—O—H
【解析】
试题分析:(1)A.由于CH2O分子和H2O中O原子的电负性大,原子半径小,所以它们之间能形成氢键。正确。B. CH2O和CO2分子中的中心原子前者采用sp2杂化,后者采用sp杂化。错误。C.C6H6分子中的碳原子与碳原子之间含有6个σ键和1个大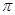 键,。碳原子与氢原子之间形成的也是σ键。化学键与化学键之间的夹角是120度。整个分子中各个化学键排列对称,电荷分布均匀。C6H6是非极性分子。错误。D.CO2晶体是分子晶体,分子间以分子间作用力结合。分子间作用力比较弱,断裂比较容易,所以它的熔点、沸点低。而二氧化硅晶体是原子晶体,原子间以强的共价键结合。断裂需要消耗很多的能量。所以使物质融化或气化需要消耗很多能量。故溶沸点高。因此CO2晶体的熔点、沸点都比二氧化硅晶体的低。正确。(2)Mn元素是25号元素,其核外电电子排布1s22s22p63s23p63d54s2.
价电子排布式为3d54s2. 气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,是因为Mn2+价电子排布式为3d5.处于半充满的稳定状态。若Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满的稳定状态转变为不稳定的3d4状态。而气态Fe2+再失去一个电子,由Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满的稳定状态。(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于d区。Ti:8×1/8+1=2;O:4×1/2+2=4;Ti:O=2:3=1:2.所以该晶体的化学式是TiO2 。。ρ·b3=(2×80)÷NA.解得ρ= 160/( NA·b3)
. (5)① H、C、N、O四种元素的电负性由小到大的顺序为H<C<N<O;② 与CNO-互为等电子体微粒的化学式为CO2(N2O)、SCN。③氰酸的结构式N≡C—O—H。
键,。碳原子与氢原子之间形成的也是σ键。化学键与化学键之间的夹角是120度。整个分子中各个化学键排列对称,电荷分布均匀。C6H6是非极性分子。错误。D.CO2晶体是分子晶体,分子间以分子间作用力结合。分子间作用力比较弱,断裂比较容易,所以它的熔点、沸点低。而二氧化硅晶体是原子晶体,原子间以强的共价键结合。断裂需要消耗很多的能量。所以使物质融化或气化需要消耗很多能量。故溶沸点高。因此CO2晶体的熔点、沸点都比二氧化硅晶体的低。正确。(2)Mn元素是25号元素,其核外电电子排布1s22s22p63s23p63d54s2.
价电子排布式为3d54s2. 气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,是因为Mn2+价电子排布式为3d5.处于半充满的稳定状态。若Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满的稳定状态转变为不稳定的3d4状态。而气态Fe2+再失去一个电子,由Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满的稳定状态。(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于d区。Ti:8×1/8+1=2;O:4×1/2+2=4;Ti:O=2:3=1:2.所以该晶体的化学式是TiO2 。。ρ·b3=(2×80)÷NA.解得ρ= 160/( NA·b3)
. (5)① H、C、N、O四种元素的电负性由小到大的顺序为H<C<N<O;② 与CNO-互为等电子体微粒的化学式为CO2(N2O)、SCN。③氰酸的结构式N≡C—O—H。
考点:考查Fe Ti等过渡元素的原子结构、晶体结构及有关计算等的知识。


科目:高中化学 来源: 题型:阅读理解
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:填空题
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是?????? 。(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个 键和1个大
键和1个大 键,C6H6是非极性分子
键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
元??? 素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 |
Mn元素价电子排布式为?????????? ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是????????????????????????? 。
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。
(4)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为???????????? 。

(5)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为??????????????????? 。
②与CNO-互为等电子体微粒的化学式为?????????? (写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式?????? 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |

查看答案和解析>>
科目:高中化学 来源:2011年江西省新余一中高考化学模拟试卷(解析版) 题型:解答题
| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com