
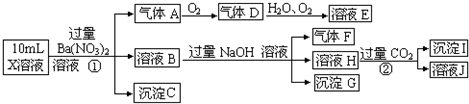
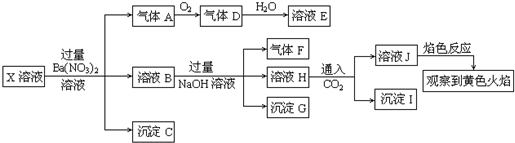
(16分)某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:

根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离是 ,不能确定是否含有的离子(Q)是 ,若要确定该Q(若不止一种,可任选一种)不存在,最可靠的化学方法是 。
(2)沉淀G的化学式为 。
(3)写出有关离子方程式:①中生成A 。
② 。
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,当沉淀C物质的量(填“<”、“=”或“>”某个值) ,表明Q离子一定是 。(若不止一种可能,填对一种情况即可)
(1)Al3+、NH4+、Fe2+、SO42-; Fe3+ 、Cl-;
取少量X溶液放在试管中,加入几滴KSCN,溶液不变红色说明无Fe3+;或者取少量B溶液放在试管中,加入几滴AgNO3溶液,无白色沉淀说明无Cl-(只要答对一种即可得分,但必须强调取X溶液或B溶液,没取或取错不得分) (其它合理答案也可)
(2)Fe(OH)3
(3)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O; AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(4)>0.07mol,Fe3+或者<0.07mol,Cl-(只要写出一种即可得分)
【解析】溶液显酸性,所以CO32-、SO32-不能大量共存。根据①可知沉淀是C是硫酸钡,则原溶液中含有SO42-,溶液中不能含有Ba2+。气体A是硝酸的还原产物NO,所以一定有NO3-和 Fe2+。溶液B和氢氧化钠反应生成气体F,则F是氨气,因此含有NH4+。沉淀G是氢氧化铁沉淀,但由于含有亚铁离子,所以无法确定铁离子。根据反应②可知,沉淀I是氢氧化铝沉淀,这说明H中含有偏铝酸钠,即原溶液中含有Al3+。
(1)铁离子和氯离子无法确定,可用KSCN溶液和硝酸银溶液分别进行检验。
(2)(3)略
(4)NO是0.01mol,则根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O可知亚铁离子是0.03mol,NO3-是0.01mol。氨气和氢氧化铝都是0.01mol,所以溶液中含有0.01mol NH4+和0.01mol Al3+。氢离子是0.04mol,所以溶液中的阳离子的正电荷数是0.14mol,所以如果硫酸钡>0.07mol,则一定含有Fe3+。如果硫酸钡<0.07mol,则一定含有Cl-。


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| H | + 4 |
| O | 2- 3 |
| O | 2- 3 |
| O | 2- 4 |
| O | - 2 |
| O | - 3 |
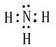
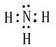
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X中肯定存在Na+、Fe2+、Al3+、NH4+、SO42- | B、气体F经催化氧化可直接生成气体D | C、沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH )3 | D、X中不能确定的离子是 Al3+、Na+、K+和Cl- |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省杭州市高三上学期期中七校联考化学试卷(解析版) 题型:选择题
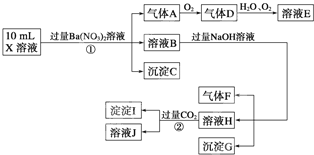
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶液进行连续实验,实验过程及产物如下:

下列说法正确的是
A.气体A是NO2 B.X中肯定存在Fe2+、A13+、NH4+、SO42―
C.溶液E和气体F不能发生化学反应 D.X中不能确定的离子是 A13+和C1―
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com