
| A. | 标准状况下,2.24 CCl4中含有0.4NA个碳氯单键 | |
| B. | 22.4LCl2通入水中充分反应,共转移NA个电子 | |
| C. | 1 L 1 mol/L的氯化铜溶液中Cu2+的数目小于NA | |
| D. | 5.6g铁在0.1 mol氯气中充分燃烧,转移的电子数为0.3NA |
分析 A.标准状况下四氯化碳的状态不是气体;
B.没有告诉标准状况下,不能使用标准状况下的气体摩尔体积计算;
C.铜离子部分水解,导致溶液中铜离子数目减少;
D.5.6g铁的物质的量为0.1mol,0.1mol铁完全反应消耗0.15mol氯气,氯气不足,需要根据氯气的量计算转移的电子数.
解答 解:A.标准状况下,四氯化碳不是气体,不能使用标准状况下的气体摩尔体积计算,故A错误;
B.不是标准状况下,不能使用标准状况下的气体摩尔体积计算22.4L氯气的物质的量,故B错误;
C.1L 1mol/L的氯化铜溶液中含有1mol氯化铜,由于铜离子部分水解,导致Cu2+的数目小于NA,故C正确;
D.5.6g铁的物质的量为:$\frac{5.6g}{56g/mol}$=0.1mol,0.1mol铁完全反应消耗0.15mol氯气,氯气不足,0.1mol氯气完全反应转移0.2mol导致,转移的电子数为0.2NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标准状况下气体摩尔体积的使用条件.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 叙述 | 判断 |
| A | 1molH2O | 标准状况下,其体积约为22.4L | 正确 |
| B | 2gH2 | 常温常压下,有NA个氢分子 | 错误 |
| C | 1L0.1mol?L-1NaCl溶液 | 取出100mL,NaCl的物质的量浓度为0.1mol?L-1 | 正确 |
| D | 1mol?L-1Na2SO4溶液 | 将1molNa2SO4固体溶于1L水可配得该溶液 | 正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
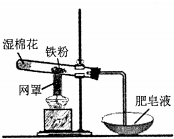
| A. | 该反应属于复分解反应 | |
| B. | 网罩的作用是集中火焰,提高温度 | |
| C. | 湿棉花的作用是给试管降温,防止炸裂 | |
| D. | 反应中水既不是氧化剂,也不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗硅制备单晶硅不涉及氧化还原反应 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 硅在电子工业中,是重要的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8KJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+285.8KJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6KJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
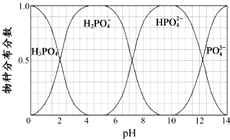 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com