


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 步骤 | 操作 | 现象 |
| Ⅰ | 向2mL 1mol?L-1 FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1mol?L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 和
和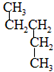
 和
和 ⑦CH3CH2CH2CH3和
⑦CH3CH2CH2CH3和 
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器均发生如下反应:A(g)+3B(g)?2C(g)
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器均发生如下反应:A(g)+3B(g)?2C(g)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铁胶体稳定存在的主要原因是氢氧化铁胶体带正电荷 |
| B、向BaCl2溶液中通入SO2气体会产生白色沉淀 |
| C、CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| D、CuSO4?5H2O是一种纯净物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com