
科目:高中化学 来源: 题型:阅读理解
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.72 |
| 2 | 20.00 | 1.20 | 21.38 |
| 3 | 20.00 | 2.00 | 22.20 |
查看答案和解析>>
科目:高中化学 来源:读想用 高二化学(上) 题型:013
|
将4.00 g Fe、Mg合金投入到足量的一定浓度的硝酸中,金属与硝酸完全反应,共收集到标准状况下的气体V L(HNO3被还原为NO和NO2);若向反应后的溶液中加入足量的氢氧化钠溶液,待金属元素全部沉淀后,再将沉淀过滤、洗净、干燥后称量其质量为8.25 g.则收集到的气体体积V值可为 | |
| [ ] | |
A. |
1.12 |
B. |
5.34 |
C. |
7.26 |
D. |
8.23 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省苏北四市高三上期末统考化学试卷(解析版) 题型:简答题
已知黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点。某研究小组先将某废水中Fe2+氧化为Fe3+,再加入Na2SO4使其生成黄钠铁矾而除去。该小组为测定黄钠铁矾的组成,进行了如下实验:
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165 g。
(1)该小组不采用生成Fe(OH)3沉淀的方法除去铁元素,是因为生成的Fe(OH)3 。
(2)用Na2S2O3溶液进行滴定时,使用的指示剂为 ,滴定到终点的颜色变化为 。
(3)通过计算确定黄钠铁矾的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省宁德市高三毕业班质量检查化学试卷 题型:填空题
(16分)
碘及其化合物在生产、生活和科技等方面都有重要应用。请回答下列问题:
(1)保存碘单质时应注意的问题是____ 。
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子:
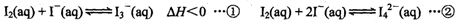
反应②的平衡常数K= (填表达式)。
温度升高时,反应①的平衡常数将 (填“增大”、“不变”或“减小”)。
(3)某化学课外小组用海带为原料制得少量含碘离子的溶液。现用该溶液进行下列实验:
①用高锰酸钾滴定法测碘离子浓度。反应为:
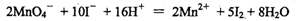
滴定20.00 mL该溶液需0.10 mol·L-1的酸性高锰酸钾溶液10.25 mL,则该溶液中碘离子的浓度为 mol·L-1(精确到0.01)。
②用下列流程制取少量碘单质:
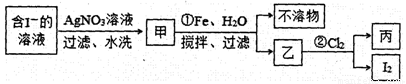
步骤①的离子方程式为 ,在该步骤中,加入100 mL水和足量的铁粉,充分搅拌,当消耗1.4 g Fe时,悬浊液中的c(Ag+)= 。[假设实验过程中溶液体积不变;此温度下Ksp(AgI)=8.3×10-17]
(4)I2O5是白色粉末状固体,可用作氧化剂使H2S、CO、HC1等氧化,在合成氨工业中常用I2O5来定量测量CO的含量。
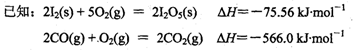
写出CO(g)与I2O5(s)反应析出固态I2的热化学方程式:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com