
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.2mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
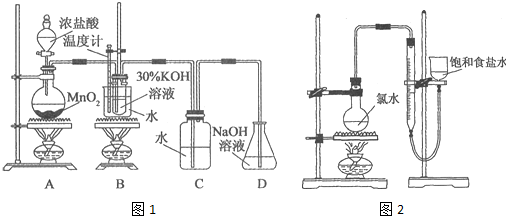
分析 实验一制取氯酸钾和氯水
A装置二氧化锰和浓盐酸来制取氯气,该反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,B装置:氯气与热的KOH溶液发生反应3Cl2+6KOH(浓)$\frac{\underline{\;\;△\;\;}}{\;}$5KCl+KClO3+3H2O,产生氯酸钾和氯化钾及水,挥发出的HCl极易溶于水,和氢氧化钾反应HCl+KOH=KCl+H2O,尾气用氢氧化钠吸收,Cl2+2NaOH=NaCl+NaClO+H2O,
(1)制取实验结束后,取出B中试管冷却结晶需要玻璃仪器烧杯、过滤、洗涤需要漏斗、玻璃棒、胶头滴管;
(2)实验室用二氧化锰和浓盐酸来制取氯气,制得的氯气中含有氯化氢,HCl极易溶于水,能和KOH反应生成KCl杂质,若对调B和C装置,可以除去氯化氢杂质,能提高B中氯酸钾的产率;
实验二氯酸钾与碘化钾反应的探究
(3)①根据表格数据分析:试管1、2、3、4中都是0.20mol•L-1KI/mL,KClO3(s)0.10g,改变的只有硫酸的体积和水的量,所以研究的目的就是研究反应体系中硫酸浓度对反应产物的影响;
②1号试管硫酸浓度未0,设计1号试管实验的作用是做对照实验,比较硫酸浓度对反应产物的影响;
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色说明有碘单质生成,假设氧化产物唯一,还原产物为氯化钾,根据氧化还原反应中电子守恒和原子守恒书写该反应的离子方程式;
实验三测定饱和氯水中氯元素的总量
(4)氯气能溶于水,次氯酸不稳定易分解生成氯化氢、氧气,因存在氯气的重新溶解以及次氯酸分解等,此方案无法测算试样含氯总量;
(5)根据题干信息次氯酸会破坏酸碱指示剂,因此实验设计时不用酸碱指示剂,可以利用氯水的强氧化性,向该溶液中加入足量的H2O2溶液,发生氧化还原,H2O2被氧化变为O2,氯气被还原成Cl-,然后加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,发生沉淀反应Ag++Cl-=AgCl↓产生沉淀,称量沉淀质量,根据氯元素守恒确定氯元素的质量.
解答 解:实验一制取氯酸钾和氯水
(1)制取实验结束后,取出B中试管,进行冷却结晶操作需要烧杯、过滤需要漏斗和玻璃棒,洗涤需要玻璃仪器烧杯盛放液体,需用玻璃棒引流、需用胶头滴管移取少量液体,
故答案为:烧杯、漏斗、玻璃棒、胶头滴管;
(2)实验室用二氧化锰和浓盐酸来制取氯气,制得的氯气中含有氯化氢,HCl极易溶于水,能和KOH反应生成KCl杂质,若对调B和C装置,可以除去氯化氢杂质,能提高B中氯酸钾的产率,
故答案为:能;
实验二氯酸钾与碘化钾反应的探究
(3)①根据表格数据分析:对照试管1、2、3、4中数据发现都是0.20mol•L-1KI/mL,KClO3(s)0.10g,改变的只有硫酸的体积和水的量,所以研究的目的是研究反应体系中硫酸浓度对反应产物的影响,
故答案为:研究反应体系中硫酸浓度对反应产物的影响;
②1号试管硫酸浓度为0,设计1号试管实验的作用是做对照实验,比较硫酸浓度影响反应产物,
故答案为:硫酸浓度为0的对照实验;
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色说明有碘单质生成,假设氧化产物唯一,还原产物为氯化钾,Cl(+5→-1)I(-1→0),根据氧化还原反应中电子守恒和原子守恒,该反应的离子方程式为:ClO3-+6I-+6H+=Cl-+3I2+3H2O,
故答案为:ClO3-+6I-+6H+=Cl-+3I2+3H2O;
实验三测定饱和氯水中氯元素的总量
(4)氯气能溶于水且能和水反应Cl2+H2O?HCl+HClO,次氯酸不稳定易分解2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,因存在氯气的重新溶解以及次氯酸分解等,此方案无法测算试样含氯总量,
故答案为:因存在氯气的重新溶解以及次氯酸分解等,此方案无法测算试样含氯总量;
(5)根据题干信息次氯酸会破坏酸碱指示剂,因此实验设计时不用酸碱指示剂,可以利用氯水的强氧化性,向该溶液中加入足量的H2O2溶液,发生氧化还原,H2O2被氧化变为O2,氯气被还原成Cl-,充分反应,再加入足量的硝酸银溶液,发生沉淀反应Ag++Cl-=AgCl↓产生沉淀,称量沉淀质量,根据氯元素守恒确定氯元素的质量,
故答案为:量取一定量的试样,加入足量的H2O2溶液,充分反应,再加入足量的硝酸银溶液,称量沉淀质量.
点评 本题考查氯及其化合物的性质,侧重考查化学仪器的使用、实验方案的设计与评价、离子方程式的书写等知识,掌握实验室制取氯气是解答的关键,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 集中处理废旧电池,以防止重金属污染环境 | |
| B. | 海产品中加入大量甲醛以延长保鲜期 | |
| C. | 食用蔬菜水果可以补充人体所需维生素 | |
| D. | 使用加碘盐,可预防因缺碘引起的甲状腺肿大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中 | |
| B. | 反应①Na2SiO3+H2O+CO2═Na2CO3+H2SiO3↓,反应②Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$NaSiO3+CO2↑,两反应是相互矛盾的,不可能都发生 | |
| C. | 普通玻璃、石英玻璃、水泥等均属于硅酸盐材料 | |
| D. | 祖母绿的主要成分为Be3Al2Si6O18,用氧化物形式表示为3BeO•Al2O3•6SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )
)| A. | ①②③ | B. | ② | C. | ③ | D. | 都不是 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
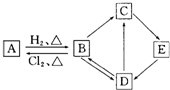 图中的每一方格表示相关的一种反应物或生成物.其中B是一种单质,其余物质也都是有B元素的化合物.C是一种钠盐,E是C的对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去),请填写空白:
图中的每一方格表示相关的一种反应物或生成物.其中B是一种单质,其余物质也都是有B元素的化合物.C是一种钠盐,E是C的对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去),请填写空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的CaCl2和CaO2含有的离子数 | |
| B. | 等质量的水与重水含有的电子数 | |
| C. | 同温、同压同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com