
| A. | 钠钾合金比纯钠的熔点高 | |
| B. | 鉴别碳酸氢钠中含有纯碱的方法是加热看是否有气体生成 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 |
分析 A、合金的熔点低硬度大;
B、碳酸氢钠受热分解生成二氧化碳,碳酸钠受热不分解;
C、水晶是二氧化硅的晶体;
D、硅元素是两性元素位于金属和非金属的分界线处.
解答 解:A、钠与钾合金的熔点降低,钠钾合金比纯钠的熔点低,故A错误;
B、碳酸氢钠受热分解生成二氧化碳,碳酸钠受热不分解,加热看是否有气体生成不能鉴别碳酸氢钠中含有纯碱,故B错误;
C、水晶的成分为二氧化硅属于氧化物,不是硅酸盐,故C错误;
D、硅元素是两性元素,表现金属和非金属的性质,周期表中处于金属与非金属的交界位置,故D正确;
故选D.
点评 本题考查了物质性质的分析应用,注意掌握物质组成和性质的理解应用,掌握基础是解题关键,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | NaHCO3 | C. | 浓H2SO4 | D. | Na2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 一定含有SO42-和Ag+ | D. | 可能含有SO42-或Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中用生石灰与浓氨水混合的方法不能制得氨气 | |
| B. | 中和滴定实验中,所用滴定管和锥形瓶均不能用待装液润洗 | |
| C. | 在加热的情况下,烧瓶中的液体体积不要超过烧瓶容积的1/3 | |
| D. | 将KI和FeCl3溶液混合后,加入CCl4振荡静置,下层液体变紫色,说明氧化性:Fe3+>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 | B. | N2 | C. | H2 | D. | O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
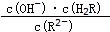 将减小(填“增大”或“减小”或“不变”或“无法判断”)
将减小(填“增大”或“减小”或“不变”或“无法判断”)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com