
含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2、O2 。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测算模拟烟气通过转化器的脱硫效率。
回答下列问题:
Ⅰ.模拟烟气的制备
(1)用A装置制SO2,化学反应方程式为 。
(2)用B装置制CO2,使用该装置优点的是 。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
II.测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,其中C、D中盛有的药品分别是 、 。(填序号)
①KMnO4溶液;②饱和NaHSO3溶液;③饱和Na2CO3溶液;④饱和NaHCO3溶液
(5)若模拟烟气的流速为amL/min,若t1分钟后,测得量筒内液体体积为VmL,则SO2的体积分数是 。
Ⅲ.测算模拟烟气通过转化器的脱硫效率(已转化的SO2占原有SO2的百分比)
(6)将模拟烟气通过转化器E装置,E装置中盛有FeCl2、FeCl3的混合溶液,常温下,它可催化SO2与O2的反应,以达到脱硫目的。写出催化剂参与反应过程的离子方程式 ①SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+ ② 。
(7)若模拟烟气仍以amL/min的流速通过转化器E装置,t2分钟后,向E装置中加入酸化的BaCl2溶液得到白色浑浊液,经 、洗涤、 、称量,得到mg固体。若实验的气体体积已折算为标准状况,则该转化器的脱硫效率是 。
Ⅰ.(1)Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑(2分)
(2)可以随时控制反应的发生和停止(2分)
Ⅱ.(4)① ④(各1分)(5)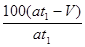 %(2分)(6)4Fe2++O2+4H+=2H2O+4Fe3+(2分)
%(2分)(6)4Fe2++O2+4H+=2H2O+4Fe3+(2分)
(7)过滤 (1分) 干燥 (1分) 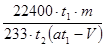 (3分)
(3分)
解析试题分析:Ⅰ.(1)实验室制备SO2是用浓硫酸与亚硫酸钠反应,反应的化学方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑。
(2)B装置是简易启普发生器,其优点是可以随时控制反应的发生和停止。
Ⅱ.(4)由于SO2易溶于水,所以C装置中的试剂应该是原来吸收SO2,可以利用SO2的还原性借助于酸性高锰酸钾溶液氧化。CO2气体能溶于水,所以D装置应该用饱和碳酸氢钠溶液通过排水法收集液体来测量SO2的体积。
(5)若模拟烟气的流速为amL/min,若t1分钟后,测得量筒内液体体积为VmL,这说明混合气中CO2、氮气和氧气的体积之和为Vml,则SO2的体积是t1amL-Vml,所以二氧化硫的体积分数是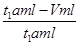 ×100%=
×100%=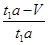 ×100%。
×100%。
(6)催化剂在反应前后是不变的,因此常温下,若它可催化SO2与O2的反应,以达到脱硫目的。则根据第一步反应SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+可知,第二步反应一定是氧气再将亚铁离子转化为铁离子,则反应的离子方程式为4Fe2++O2+4H+=2H2O+4Fe3+。
(7)所得白色沉淀是硫酸钡,层溶液中分离出硫酸钡的操作应该是过滤、洗涤、干燥、称量。根据(5)中SO2的含量可知,理论上应该生成硫酸钡的质量为 ×233,因此该转化器的脱硫效率是
×233,因此该转化器的脱硫效率是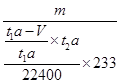 =
=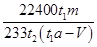
考点:考查SO2制备、性质检验、实验方案设计与评价以及含量测定等


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:计算题
钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。下图是以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料生产钛白粉并获得副产品FeSO4·7H2O的工艺流程图。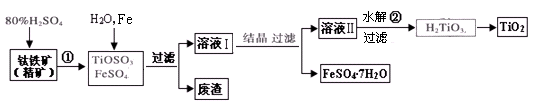
(1)钛铁矿与硫酸发生反应①的化学方程式为 ;在TiOSO4和FeSO4溶液中加入Fe的目的是 。
(2)溶液Ⅱ中TiOSO4在加热条件下发生水解反应②的离子方程式为 ;可回收利用的物质是 。
(3)为测定溶液Ⅱ中TiOSO4的含量,首先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用 (填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,当溶液出现红色达到滴定终点,用去了30.00mL FeC13溶液。待测钛液中TiOSO4的物质的量浓度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(19分)黄铜矿的主要成分是CuFeS2(硫元素显 价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
已知:
 =
=
(1)在实验室中,应将黄铜矿粉末放在__________(填仪器名称)中焙烧。
(2)将反应过程中产生的SO2和H2S通入下图所示装置中检验它们的性质。该实验证明SO2具有_________性和__________性。
(3)欲选用下列部分装置在实验室中以MnO2和浓盐酸为原料制取纯净、干燥的氯气。 
①圆底烧瓶中发生反应的离子方程式为_________________________________________。
②按气流方向由左到右,导管口连接顺序为a→__________________________________。
③装置连接好后,在装药品前,需检验装置的气密性,具体方法是__________________。
④向滤液A中通入C12,某同学取通入C12后的溶液滴加KSCN溶液,用来证明C12的氧化性比Fe3+强的结论。该实验设计是否合理________(填“是”或“否”),请用简要文字解释你的理由_____________________________________________________________。
(4)若使用20 g黄铜矿粉末可制得8 gFe2O3(铁红),则该黄铜矿中含CuFeS2的质量分数是________ (假设各步反应均完全进行且过程中无额外物质损耗)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)已知:BaSO4(s)+4C(s) 高温4CO(g)+BaS(s)
工业上以重晶石矿(主要成分BaSO4,含杂质Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
(1)若按以上流程在实验室焙烧重晶石矿,回收处理所产生的气体,恰当的方法是 (填字母编号)。
a.用澄清石灰水吸收气体 b.用浓硫酸吸收气体 c.点燃气体
(2)焙烧重晶石矿时,可能发生的副反应的化学方程式是 (写两个)。
(3)为测定产品氯化钡晶体(BaCl2·nH2O)中的n值,设计下列实验步骤,请补充完善空缺项的实验步骤:①称量样品;②灼烧样品;③置于 (填仪器名称)中冷却;④ ;⑤恒重操作。恒重操作的目的是 ;若最终测出的n值偏大,可能的实验操作误差原因是 (举例一种情况)。
(4)用下列装置组合也可完成(3)中实验。请选择下列恰当的装置组合(称量、加热和夹持仪器省略),完成上述实验: (用装置代号以“A
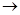 ……
…… ”形式表示,每套装置不可重复使用)
”形式表示,每套装置不可重复使用)
(5)将重晶石矿与碳、氯化钙共同焙烧,可以直接得到氯化钡,反应的化学方程式为:
BaSO4+4C+CaCl2高温4CO +CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。
+CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的
实验装置。
(1)实验室用装置A制备SO2某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未
流下,你认为原因可能是:
(2)实验室用装置E制备Cl2其反应的化学化学方程式为:MnO2+4HCl(浓)=C12↑+MnCl2+2H2O
浓盐酸的作用为:
(3)反应开始一段时间后,观察到 B、D两个试管中的品红溶液出现的现象是:
B: D 。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B: D 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性.二者混合后的漂白性肯定会更强。他们将制得的SO2和CI2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示): 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
制备氮化镁的装置示意图如下:
回答下列问题:
(1)检查装置气密性的方法是________________________________,
a的名称是________,b的名称是________;
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式___________________;
(3)C的作用是______________________________________________________,
D的作用是____________________________________________________,
是否可以把C和D的位置对调并说明理由_____________________________;
(4)写出E中发生反应的化学方程式_________________________________;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫酸铜晶体俗称“胆矾”,在无机化工及生产生活中有广泛的应用。某课外研究小组的同学用粗铜粉(含有碳等杂质)设计了两种制备胆矾的途径,并测定了其中结晶水的含量。设计的流程如下: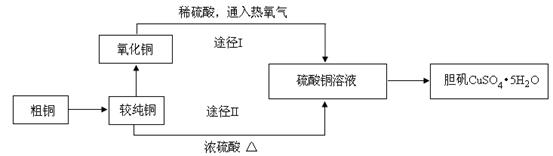
(1)“较纯铜”转化为氧化铜时,应将其置于 内进行灼烧(填写仪器名称)。“粗铜”表面的油脂可以用热碱溶液洗去,原因是 。若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜。存在少量铜的可能原因是 。
a.灼烧过程中部分氧化铜被还原 b.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧不充分铜未被完全氧化
(2)通过途径I实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。比较由粗制氧化铜制取胆矾的两种途径,途径Ⅰ有明显的两个优点:
① 。
② 。
(3)测定胆矾晶体里结晶水的含量时,若测定的相对误差大于零,则产生误差的原因可能是___________。
a.加热后容器未放入干燥器中冷却
b.最后两次加热后的质量相差较大
c.加热前称量时容器未完全干燥
d.加热过程中有少量溅失
(4)利用下图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量见图下方的表格所示。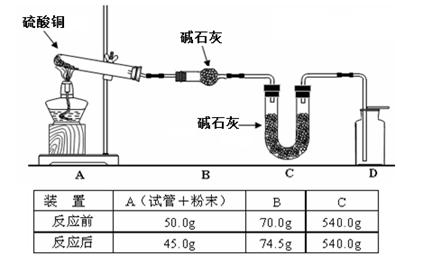
请通过计算,推断该实验条件下硫酸铜分解的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学生利用以下装置探究喷泉实验。其中A、F分别为硫化氢和氯气的发生装置,C为纯净干燥的氯气与硫化氢反应的装置。
请回答下列问题:
(1)装置F中发生反应的化学方程式 。
(2)装置A中的分液漏斗内液体a可选用 (选填以下选项的代号)
A.盐酸 B.浓硫酸 C.稀硫酸 D.稀硝酸
(3)虚线框内应添加必要的除杂装置,请从上图的“备选装置”中选择合适装置的编号,填入下列空格。B__________、D__________、E__________。
(4)打开K1、K2,将常温压下的H2S、Cl2以体积比1:1充满烧瓶后,烧瓶中发生的反应用化学方程式表示为 ;关闭K1、K2,始终看不到烧瓶内产生“喷泉”现象,理由是: 。
(5)在操作(4)的基础上,引发喷泉操作方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要含有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下:
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物 质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com