
物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是 (填物质字母代号)。
| 代号 |
| 结构式 | 水中溶液解度/g(25℃) | 熔点/℃ | 沸点/℃ | ||
| A | 邻―硝基苯酚 |
| 0.2 | 45 | 100 | ||
| B | 对―硝基苯酚 |
| 1.7 | 114 | 295 |
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
| 代号 | 物质 | 结构式 | 水中溶解度/g (25℃) |
熔点/℃ | 沸点/℃ |
| A | 邻-硝基苯酚 |  |
0.2 | 45 | 100 |
| B | 对-硝基苯酚 | 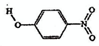 |
1.7 | 114 | 295 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 代号 | 物质 | 结构简式 | 水中溶解度/g (25℃) |
熔点/℃ | 沸点/℃ |
| A | 邻-硝基苯酚 |  |
0.2 | 45 | 100 |
| B | 对-硝基苯酚 |  |
1.7 | 114 | 295 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)(1)前三周期元素中第一电离能最小的是 (填元素符号),其基态原子的电子排布式为 。第二周期非金属元素形成的氢化物中化学键极性最大的是 (填分子式),该物质在CCl4中的溶解度比在水中的溶解度 (填“大”或“小”)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是 (填物质字母代号)。
(3)晶格能的大小:MgO NaCl,键能的大小:HBr HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
查看答案和解析>>
科目:高中化学 来源:2014届福建省高二上学期期末考试化学试卷(解析版) 题型:填空题
(5分)(1)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是___________ (填物质字母代号)。
|
代号 |
物质 |
结构简式 |
水中溶解度/g (25℃) |
熔点/℃ |
沸点/℃ |
|
A |
对—硝基苯酚 |
|
1.7 |
114 |
295 |
|
B |
邻—硝基苯酚 |
|
0.2 |
45 |
100 |
(2)由C、H、O、S中任两种元素构成甲、乙、丙三种分子,所含原子的数目依次为3、4、8,都含有18个电子。甲和乙的主要物理性质比较如下:
|
|
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
甲 |
187 |
202 |
2.6 |
|
乙 |
272 |
423 |
以任意比互溶 |
①1 mol乙分子含有 个σ键;
②丙分子的中心原子采取 杂化轨道;
③甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是
(结合具体物质解释)。
查看答案和解析>>
科目:高中化学 来源:2010年江苏省高二下学期期末考试化学试题 题型:填空题
(12分)(1)前三周期元素中第一电离能最小的是 (填元素符号),其基态原子的电子排布式为 。第二周期非金属元素形成的氢化物中化学键极性最大的是 (填分子式),该物质在CCl4中的溶解度比在水中的溶解度 (填“大”或“小”)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是 (填物质字母代号)。

(3)晶格能的大小:MgO NaCl,键能的大小:HBr HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com