
重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
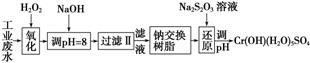
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR—→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O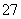 转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O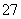 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O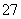 的废水:
的废水:
该法用Fe作电极电解含Cr2O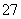 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是________________________________________________________________________。
(2)电解时阳极附近溶液中Cr2O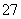 转化为Cr3+的离子方程式为__________________________
转化为Cr3+的离子方程式为__________________________
______________________________________________。
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为________时才能使c(Cr3+)降至10-5 mol·L-1。
答案 Ⅰ.(1)A
(2)AB CD
(3)3S2O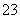 +4Cr2O
+4Cr2O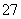 +26H+===6SO
+26H+===6SO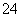 +8Cr3++13H2O
+8Cr3++13H2O
Ⅱ.(1)不能 因阳极产生的Cu2+不能使Cr2O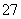 还原到低价态
还原到低价态
(2)Cr2O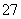 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
(3)5
解析 Ⅰ.(1)加入的氧化剂不能引入难处理的杂质离子,B项中引入NO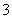 ,D项引入MnO
,D项引入MnO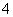 、Mn2+。
、Mn2+。
(2)由表格信息可知,Fe3+完全沉淀的pH=3.7,Al3+完全沉淀的pH=8,因而当加NaOH调pH=8时,Al3+、Fe3+完全沉淀;此工艺流程的最终目的要获得Cr(OH)(H2O)5SO4,还应将Mg2+、Ca2+除去,因而钠离子交换树脂除去的是Ca2+和Mg2+。
(3)还原过程中,1 mol Cr2O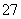 得到电子数=
得到电子数=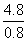 mol=6 mol,知其还原产物为Cr3+,S2O
mol=6 mol,知其还原产物为Cr3+,S2O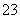 的氧化产物为SO
的氧化产物为SO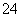 。
。
Ⅱ.(1)电解法是用Fe提供还原剂Fe2+,同时提高溶液的pH。
(3)c(OH-)=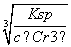 =
=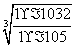 mol·L-1=1×10-9mol·L-1,所以pH=5。
mol·L-1=1×10-9mol·L-1,所以pH=5。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
某课外活动小组设计了以下实验方案验证Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
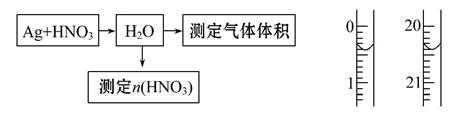
(1)测定硝酸的物质的量:
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用
0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B装置中生成硝酸的物质的量为 ,则Ag与浓硝酸反应过程中生成的NO2的物质的量为 。
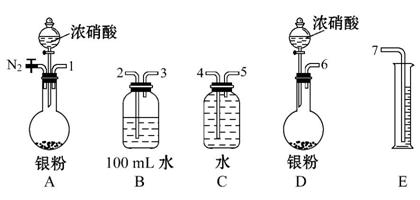
(2)测定NO的体积:
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验,选用的理由是 。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是 (填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置 (选填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析:
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中 (选填“有”或“没有”)NO产生,作此判断的依据是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在实验室进行了如图所示的实验,下列说法中错误的是( )
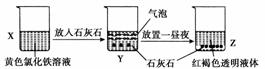
A.利用过滤的方法,可将Z中固体与液体分离
B.X、Z烧杯中分散质相同
C.Y中反应的离子方程式为3CaCO3+2Fe3++3H2O===2Fe(OH)3+3CO2↑+3Ca2+
D.Z中分散系能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
新型高效絮凝剂Fe(OH)SO4(碱式硫酸铁)常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:
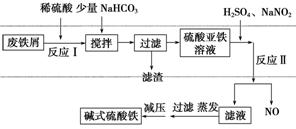
部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
请回答下列问题:
(1)加入少量NaHCO3的目的是调节溶液的pH,除去Al3+,①pH的范围__________,②写出可能发生的离子方程式:________________。
(2)在实际生产中,反应Ⅱ中常同时通入O2,以减少NaNO2的用量,O2与NaNO2在反应中均作________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成Fe2(OH) ,该水解反应的离子方程式为________________________________________________________________________。
,该水解反应的离子方程式为________________________________________________________________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO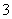 。为检验所得的产品中是否含有Fe2+,应使用的试剂为________(填序号)。
。为检验所得的产品中是否含有Fe2+,应使用的试剂为________(填序号)。
a.氯水 b.KSCN溶液
c.NaOH溶液 d.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢。在如图所示装置中,观察到图(a)装置铜电极上产生大量的无色气泡,而图(b)装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是( )
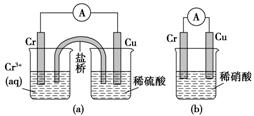
A.图(a)为原电池装置,Cu电极上产生的是O2
B.图(b)装置中Cu电极上发生的电极反应式为Cu-2e-===Cu2+
C.由实验现象可知:金属活动性Cu>Cr
D.两个装置中,电子均由Cr电极流向Cu电极
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室里进行物质制备,下列从原料及有关试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( )
A.C CO
CO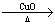 CO2
CO2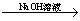 Na2CO3溶液
Na2CO3溶液
B.Cu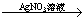 Cu(NO3)2溶液
Cu(NO3)2溶液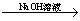 Cu(OH)2
Cu(OH)2
C.Fe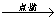 Fe2O3
Fe2O3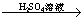 Fe2(SO4)3溶液
Fe2(SO4)3溶液
D.CaO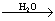 Ca(OH)2溶液
Ca(OH)2溶液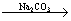 NaOH溶液
NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学研究小组,通过网上查找资料发现,Cl2的制取有下列不同方案:
a方案:加热条件下二氧化锰与浓盐酸反应制得Cl2
b方案:浓盐酸与氯酸钾固体反应制得Cl2
c方案:电解饱和食盐水法制得Cl2
现实验室有供选择的如下几种仪器来制取Cl2

(1)用上述仪器不能实现的方案为 。不考虑固定装置的仪器,可行但缺仪器的方案是 ,所缺的仪器是 。
(2)若按b方案制Cl2,发生反应的化学方程式为 ,
要制取并收集纯净的Cl2(允许含有少量水蒸气或空气),须使用到上述仪器中的(按气流从左到右的流向顺序列出) 。
(3)若要设计联合实验探究氯气的漂白反应物质,从制备装置中产生氯气后应连接的装置是(画出装置图并注明所使用的试剂或用品)
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应2AB(g) C(g)+ 3D (g)在高温下能自发进行,其逆反应在低温下能自发进行,
C(g)+ 3D (g)在高温下能自发进行,其逆反应在低温下能自发进行,
则该反应的Δ H、Δ
H、Δ S应为
S应为
A.ΔH <0,ΔS>0 B.ΔH <0,ΔS<0 C.ΔH >0,ΔS> 0 D.ΔH >0,ΔS<0
0 D.ΔH >0,ΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.煤的气化和液化是使煤变成清洁能源的有效途径
B.煤的干馏过程属于物理变化,通过干馏可以得到焦炉气、煤焦油、焦炭等产品
C.工业上大量燃烧含硫燃料是形成“酸雨”的主要原因
D.煤是由非常复杂的无机物和有机物组成的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com