
| A. | 0.1mol•L-1NH4Cl溶液中:c(CI-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1mol•L-1Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) | |
| C. | 0.1mol•L-1Na2CO3溶液与同浓度等体积盐酸混合的溶液中:c(Na+)>c(CI-)>c(CO32-)>c(HCO3-) | |
| D. | 0.2mol•L-1H2C2O4(弱酸)与0.1mol•L-1NaOH溶液等体积混合的溶液中:2[c(H+)-c(OH-)]=3c(C2O42-)-c(H2C2O4)+c(HC2O4-) |
分析 A.铵根离子部分水解,溶液呈酸性,则c(Cl-)>c(NH4+)、c(H+)>c(OH-);
B.根据碳酸钠溶液中的质子守恒判断;
C.反应后溶质为等浓度的碳酸氢钠和氯化钠,碳酸氢根离子的水解程度大于其电离程度,则c(CO32-)<c(HCO3-);
D.反应后溶质为等浓度的H2C2O4和NaHC2O4,根据混合液中的核电荷数和物料守恒判断.
解答 解:A.0.1mol•L-1NH4Cl溶液中,铵根离子发生水解,溶液显示酸性,则c(H+)>c(OH-),溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A正确;
B.根据0.1mol•L-1Na2CO3溶液中的质子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故B错误;
C.0.1mol•L-1Na2CO3溶液与同浓度等体积盐酸混合,反应后溶质为等浓度的碳酸氢钠和NaCl,由于碳酸氢根离子的水解和电离程度都较小,则c(HCO3-)>c(CO32-),正确的离子浓度大小为:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-),故C错误;
D.反应后溶质为等浓度的H2C2O4和NaHC2O4,根据电荷守恒可得:①c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),根据物料守恒可得:②2c(Na+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4),将①×2-②×可得:2c(H+)+c(H2C2O4)=c(HC2O4-)+3c(C2O42-)+2c(OH-),整理可得:2[c(H+)-c(OH-)]=3c(C2O42-)-c(H2C2O4)+c(HC2O4-),故D正确;
故选AD.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒、质子守恒及盐的水解原理,试题培养了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 两种气体都是无色、有毒的,且都可用水吸收以消除对空气的污染 | |
| B. | 二氧化硫和二氧化氮分别为硫和氮的最高价氧化物 | |
| C. | 两种气体都与酸雨的形成有关 | |
| D. | 两种气体溶于水都可以与水反应,且只生成相应的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6Li和7Li互为同素异形体 | |
| B. | 锂单质与氧气反应可生成Li2O2和Li2O两种氧化物 | |
| C. | 锂原子在同周期主族元素中原子半径最大 | |
| D. | 少量锂单质保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了使婴儿对食品有更浓厚的兴趣,应在婴儿食品中加入大量的着色剂 | |
| B. | 为了使火腿肠颜色更鲜红,可多加入一些亚硝酸钠 | |
| C. | 蛋白质在人体内经消化后生成碳酸、硫酸、尿酸等,故属于酸性食物 | |
| D. | 常用的抗酸药有氢氧化铜、氢氧化铝、柠檬酸钠、碳酸钙等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气的物质的量为2摩尔 | |
| B. | 2摩尔水的摩尔质量是1摩尔水的摩尔质量的2倍 | |
| C. | 25℃,1.01×105Pa,64g的SO2中含有的原子数为3NA | |
| D. | l摩尔任何物质所含的分子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
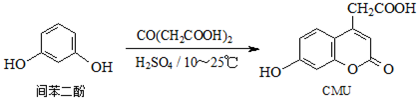
| A. | 1molCMU最多可与1molBr2反应 | |
| B. | 1molCMU最多可与3molNaOH反应 | |
| C. | 可用FeCl3溶液鉴别间苯二酚和CMU | |
| D. | CMU在酸性条件下的水解产物只有1种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com