
| A. | 向HNO2溶液中加入NaNO2固体,pH变大 | |
| B. | 用HNO2溶液做导电性实验,灯泡很暗 | |
| C. | 0.1mol•L-1的HNO2溶液的pH=2 | |
| D. | pH=3的HNO2溶液稀释至100倍后,3<pH<5 |
分析 在水溶液里或熔融状态下部分电离的电解质是弱电解质,根据亚硝酸的电离程度判断强弱电解质,如果亚硝酸部分电离,则为弱电解质.
解答 解:A.向HNO2溶液中加入NaNO2固体,pH变大,说明亚硝酸根离子浓度增大抑制亚硝酸电离平衡,氢离子浓度减小,溶液中存在电离平衡,证明亚硝酸为弱酸,故A不选;
B.溶液的导电能力与离子浓度成正比,与电解质强弱无关,故B选;
C.0.1mol•L-1的HNO2溶液的pH=2>1,说明亚硝酸不完全电离,为弱酸,故C不选;
D.pH=3的HNO2溶液稀释至100倍后,3<pH<5,说明亚硝酸溶液中存在亚硝酸电离平衡,为弱酸,故D不选;
故选B.
点评 本题考查了电解质强弱的判断,根据电解质的电离程度划分强弱电解质,与溶液导电能力无关,为易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
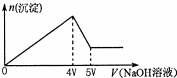 向MgCl2、Al2(SO4)3的混合溶液中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则原溶液中Mg2+与Al3+的物质的量之比是( )
向MgCl2、Al2(SO4)3的混合溶液中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则原溶液中Mg2+与Al3+的物质的量之比是( )| A. | 1:2 | B. | 1:1 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1KHS溶液中c(HS-)+c(S2-)+c(H2S)=0.1mol•L-1 | |
| B. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | pH=11的NaOH溶液与pH=3的CH2COOH溶液等体积混合后c(CH2COO-)>c(Na+)>c(H+)>c(0H-) | |
| D. | 在K2CO3溶液中:c(CO32-)+c(OH-)=c(HCO3-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 核外电子是分层运动的 | |
| B. | 所有电子在同一区域里运动 | |
| C. | 能量高的电子在离核近的区域运动 | |
| D. | 不同能量的电子在核外运动占有的区域形状可能不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化镁在医药、建筑等行业应用广泛,木炭还原硫酸镁煅烧制备高纯氧化镁是一种新的探索.煅烧过程存在以下反应:
氧化镁在医药、建筑等行业应用广泛,木炭还原硫酸镁煅烧制备高纯氧化镁是一种新的探索.煅烧过程存在以下反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室配制一定物质的量浓度NaCl溶液,用托盘天平秤取5.85gNaCl | |
| B. | 用容量瓶配制溶液时先将容量瓶洗涤并烘干 | |
| C. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| D. | 酸碱滴定时当指示剂变色后保持半分钟内不变色即达滴定终点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
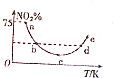 取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )
取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )| A. | 10s内,图中a点对应的N2O4反应速率为0.01mol•L-1•s-1 | |
| B. | 图中b、d两点对应的NO2速率相等 | |
| C. | c点前后平衡移动的方向相反 | |
| D. | e点对应的容器中气体颜色最深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com