
分析 (1)减小体积,二氧化氮的浓度增大,则气体颜色加深,同时增大气体压强,根据勒夏特列原理分析平衡向气体体积减小的分析进行;
(2)①根据n=cV计算生成C的物质的量,结合D的物质的量,利用物质的量之比等于化学计量数之比计算x的值;
②根据生成的D的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的B的物质的量,再利用转化率定义计算;
③降温K增大,说明降温平衡正向移动;
④可逆反应达到化学平衡状态时,正逆反应速率相等,各组分浓度保持不变,据此分析;
⑤将原容器体积扩大到4L,体积增大压强减小平衡向气体体积增大的分析进行,据此分析选项;
⑥为使该反应的反应速率增大,可采用增大压强、升高温度、加入催化剂、增大反应物浓度等方法,再结合平衡移动原理分析解答.
解答 解:(1)若向内突然推进活塞,气体的体积减小时,NO2浓度增大,则气体颜色加深,气体体积减小,则气体压强增大,平衡向正反应方向移动,二氧化氮浓度降低,所以气体颜色变浅,先变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深,混合气体质量不变,总物质的量减少,所以平均相对分子质量增大,
故答案为:深;浅;最终;最终;
(2))①n(C)=cV=0.2mol/L×2L=0.4mol,生成D0.8mol,物质的量之比等于化学计量数之比,所以x=1,故答案为:1;
②B的转化率α(B)=$\frac{0.4mol}{1mol}$×100%=40%,故答案为:40%;
③降温K增大,说明降温平衡正向移动,正反应放热,故答案为:放热;
④A、反应前后气体质量不变,容器体积不变所以气体的密度始终不变,故A不选;
B、反应前后气体物质的量不同,所以压强不变说明各组分浓度不变,反应达到平衡状态,故B选;
C、B是反应物D是生成物,生成D的反应速率是生成B的反应速率的2倍,说明正逆反应速率相等,反应达到平衡状态,生成B的反应速率是生成D的反应速率的2倍
不能说明正逆反应速率相同,不能说明反应达到平衡状态,故C不选;
D、AB都是反应物,单位时间内生成3molA,同时生成1molB是逆反应速率之比等于化学计量数之比,不能说明反应达到平衡状态,故D不选;
故答案为:B;
⑤x=1,将原容器体积扩大到4L,各组分浓度都减小,平衡向气体体积减小的正向移动,
A、体积增大各组分浓度都减小,所以B的浓度减少,故A错误;
B、将原容器体积扩大到4L,各组分浓度都减小,在正逆反应速率减慢,故B错误;
C、体积增大各组分浓度都减小,压强减小平衡向气体体积减小的正向移动,C的物质的量增加,故C正确;
D、将原容器体积扩大到4L,压强减小,平衡向气体体积减小的正向移动,A减少C增加,重新平衡时$\frac{n(A)}{n(C)}$减小,故D错误;
故答案为:C.
⑥A.及时分离除C气体平衡向右移动,但反应速率减小,故A错误;
B.反应是放热反应,适当升高温度,反应速率增大但平衡向逆反应方向移动,故B错误;
C.增大B的浓度反应速率增大,且该反应向正反应方向移动,故C正确;
D.选择高效催化剂能增大反应速率,但平衡不移动,故D错误;
故答案为:C.
点评 本题考查化学平衡的有关计算、反应速率的有关计算、平衡状态的判断、化学平衡的移动等,难度中等,注意平衡状态的判断.


科目:高中化学 来源: 题型:解答题
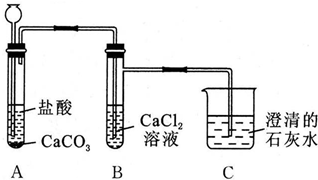
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子中所有原子都有可能处于同一平面上 | |
| B. | 都能在空气中燃烧,且燃烧时均伴有黑烟 | |
| C. | 都能被KMnO4酸性溶液氧化而使其褪色 | |
| D. | 都能与足量的溴水发生加成反应生成相同的四溴代烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将乙酸和乙醇的混合液注入浓硫酸中制备乙酸乙酯 | |
| B. | 将铜丝在酒精灯外焰上加热变黑后再移至内焰,铜丝恢复原来的红色 | |
| C. | 在试管中注入2 mL CuSO4溶液,再滴几滴NaOH溶液后,加入乙醛溶液即有红色沉淀生成 | |
| D. | 向苯酚溶液中滴加几滴稀溴水出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 方法(或操作) | 原理 |
| A | 分离溶于水中的溴 | 裂解汽油萃取 | 碘在裂解汽油中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 从蛋清中提取蛋白质 | 加入硫酸铜溶液 | 浓盐溶液使蛋白质溶解度降低 |
| D | 尿液中尿糖的检验 | 加入新制Cu(OH)2、加热 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
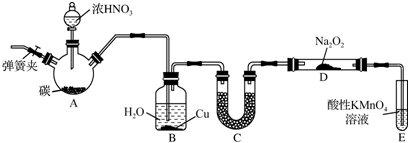
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com