
| A. | 单质的颜色逐渐加深 | B. | 单质的熔沸点逐渐降低 | ||
| C. | 单质的密度逐渐减小 | D. | 单质在水中的溶解度逐渐增大 |
分析 A.卤素单质的颜色随着原子序数增大而加深;
B.分子晶体熔沸点与其相对分子质量成正比;
C.卤素单质的密度随着原子序数增大而增大;
D.卤素单质在水中的溶解度随着原子序数增大而减小.
解答 解:A.氟气淡黄绿色气体、氯气是黄绿色气体、溴是深红棕色液体、碘是紫黑色固体,所以卤素单质的颜色随着原子序数增大而加深,故A正确;
B.分子晶体熔沸点与其相对分子质量成正比,卤素单质都是分子晶体,其单质的相对分子质量随着原子序数增大而增大,所以其单质的熔沸点随着原子序数增大而增大,故B错误;
C.卤素单质的密度随着原子序数增大而增大,故C错误;
D.氟气极易和水反应生成氢氟酸,氯气和水反应生成盐酸和次氯酸,溴在水中的溶解度较小,碘在水中的溶解度更小,所以卤素单质在水中的溶解度随着原子序数增大而减小,故D错误;
故选A.
点评 本题考查卤族元素性质递变规律,为高频考点,明确同一主族元素原子结构与其元素性质关系是解本题关键,熟练掌握元素周期律,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| B. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+═I2+O2↑+2H2O | |
| C. | 在氢氧化钡溶液中滴加硫酸氢钾溶液至PH=7:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 用碳酸钠溶液浸泡锅炉水垢:Ca2++CO32-═CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
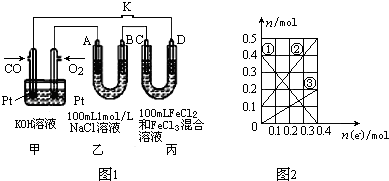
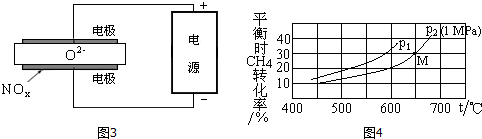
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯使溴的四氯化碳溶液褪色 | |
| C. | 甲烷与氯气混合光照一段时间后黄绿色褪色 | |
| D. | 乙烯在催化剂作用下生成聚乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2+是XO4-的还原产物 | |
| B. | 溶液中可发生:Z2+2A2+═2A3++2Z- | |
| C. | 氧化性强弱的顺序为:XO4->B2>Z2>A3+ | |
| D. | Z2在①中是氧化产物,③中是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com