
| A. | Na+、NO3-、Al3+、Cl- | B. | Na+、CO32+、K+、NO3- | ||
| C. | Cu2+、K+、SO42-、Cl- | D. | Ba2+、K+、Cl-、HS- |
分析 强酸性溶液中存在大量氢离子,无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.四种离子之间不反应,都不与氢离子反应,且为无色溶液;
B.碳酸根离子与氢离子反应;
C.铜离子为有色离子;
D.硫氢根离子与氢离子反应.
解答 解:强酸性溶液中存在大量氢离子,无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.Na+、NO3-、Al3+、Cl-之间不发生反应,都是无色离子,都不与氢离子反应,在溶液中能够大量共存,故A正确;
B.CO32+与氢离子反应,在溶液中不能大量共存,故B错误;
C.Cu2+为有色离子,不满足溶液无色的条件,故C错误;
D.HS-与氢离子反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.


科目:高中化学 来源: 题型:解答题
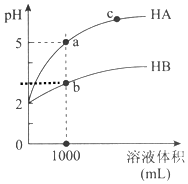 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示:
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示:| 物质 | 稀释中变化 | 稀释中n(H+)变化 | 稀释中c(H+)减小程度 |
| HA | HA=H++A-不移动 | 不变 | 大 |
| HB | HB?H++B- 正向移动 | 增加 | 小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
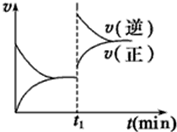 如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )
如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )| A. | 2SO2(g)+O2(g)?2SO3(g);△H<0 | B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H<0 | ||
| C. | H2(g)+I2(g)?2HI(g);△H>0 | D. | N2(g)+3H2(g)?2 NH3(g)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiCl4晶体是分子晶体 | |
| B. | 常温常压下SiCl4是气体 | |
| C. | SiCl4的分子 是由极性键形成的非极性分子 | |
| D. | SiCl4的熔点高于CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需的营养物质 | |
| B. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 | |
| C. | 金属钠具有强的还原性,可利用钠和熔融TiCl4反应制取金属Ti | |
| D. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌等疾病的发生相关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl | B. | C16H34 $→_{△}^{催化剂}$C8H18+C8H16 | ||
| C. | nCH2=CH2$\stackrel{催化剂}{→}$ | D. | C2H6O+3O2$\stackrel{点燃}{→}$2 CO2+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com