
����Ŀ��A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ��������ԭ���а뾶��С��ԭ�ӣ�BԪ�ص�����������Ӧˮ���������⻯������һ����X��D��Aͬ���壬����Eͬ���ڣ�EԪ�ص��������������������������3/4��A��B��D��E������Ԫ���У�ÿһ�ֶ���CԪ���γ�ԭ�Ӹ����Ȳ���ͬ�Ļ����
��ش��������⣺
��1��C��E��Ԫ����Ƚϣ��ǽ����Խ�ǿ��������Ԫ�����ƣ���������֤�ý��۵�������д��ţ���
A���Ƚ�������Ԫ�ص���̬�⻯��ķе�
B���Ƚ�������Ԫ�صĵ����ڳ����µ�״̬
C���Ƚ�������Ԫ�ص���̬�⻯����ȶ���
D���Ƚ�������Ԫ�صĵ������������ϵ�����
��2��д��C��D��Ԫ���γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�������E��C��Ԫ���γɵ�ԭ�Ӹ�����Ϊ1��2�Ļ����ﷴӦ�Ļ�ѧ����ʽ�� ��
��3��A��C��D��E����Ԫ�ؿ��γ�������ʽ�Σ�������ʽ�����Ӧ�����ӷ���ʽΪ
��4��A��E��A��C���γɼס��������������Ǿ�Ϊ��һ��˫ԭ�������ӣ��Ҽ���18�����ӣ�����10�����ӣ�������ҷ�Ӧ�����ӷ���ʽΪ��
��5��BԪ�ص���̬�⻯�����һ�ֳ��������˫ԭ�ӷ��ӣ��ܷ�Ӧ����B�ĵ��ʣ��÷�Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ ��
��6���ڻ���ƽ�����װ��Һ̬B2A4��Һ̬A2C2 �� ��֪0.4mol��Һ̬B2A4������Һ̬A2C2��Ӧ��������̬B2����̬A2C���ų�256.6kJ����������д���÷�Ӧ���Ȼ�ѧ����ʽ�� �� B2A4�ĵ���ʽ
��7��A2C�ķе��A2E �е� �� ԭ����
��8��������ʵ������������͵���
A.ˮ�������ȶ���
B.������Һ����
C.������������ˮ��
D.ˮ��ɱ����ܶȼ�С���������
��9���õ���ʽ��ʾ�Ȼ�����γɹ��� ��
���𰸡�
��1������CD
��2��Na2O2+SO2=Na2SO4
��3��H++HSO3��=H2O+SO2��
��4��HS��+OH��=S2��+H2O
��5��2��3
��6��N2H4��l��+2 H2O2��l��=N2��g��+4H2O��g����H=��641.5kJ?mol��1��![]()
��7���ߣ�ˮ���Ӽ�������
��8��BCD
��9��![]()
���������⣺A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ��������ԭ���а뾶��С��ԭ�ӣ���AΪHԪ�أ�BԪ�ص�����������Ӧˮ���������⻯����������X����BΪNԪ�أ�XΪNH4NO3��D��Aͬ���壬D��ԭ���������ڵ�����DΪNa��D��Eͬ���ڣ������ڵ������ڣ�EԪ��ԭ�ӵ�������������������������� ![]() ����EΪSԪ�أ�A��B��D��E������Ԫ�أ�ÿһ����CԪ�ض����γ�Ԫ�ص�ԭ�Ӹ����Ȳ���ͬ�Ķ��ֻ������CΪOԪ�أ�
����EΪSԪ�أ�A��B��D��E������Ԫ�أ�ÿһ����CԪ�ض����γ�Ԫ�ص�ԭ�Ӹ����Ȳ���ͬ�Ķ��ֻ������CΪOԪ�أ�
��1.��ͬ�������϶��·ǽ����Լ���������Ԫ�صķǽ����Ա����ǿ���Ƚ��⻯���ȶ��Ի������������ϵ����׳̶ȵȿ����жϷǽ�����ǿ�������ʵķе����������ԣ������жϷǽ�����ǿ�����⻯��е�Ҳ�����жϷǽ�����ǿ�������Դ��ǣ�����CD��
��2.��C��D��Ԫ���γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ΪNa2O2 �� E��C��Ԫ���γɵ�ԭ�Ӹ�����Ϊ1��2�Ļ�����ΪSO2 �� ���߷�Ӧ����ʽΪ��Na2O2+SO2=Na2SO4 �� ���Դ��ǣ�Na2O2+SO2=Na2SO4��
��3.��H��O��Na��S����Ԫ�ؿ��γ�������ʽ��ΪNaHSO3��NaHSO4 �� ���߷�Ӧ�����ӷ���ʽΪ��H++HSO3��=H2O+SO2�������Դ��ǣ�H++HSO3��=H2O+SO2����
��4.��H��S��H��O���γɼס��������������Ǿ�Ϊ��һ��˫ԭ�������ӣ��Ҽ���18�����ӣ�����10�����ӣ����ΪHS�� �� ��ΪOH�� �� ������ҷ�Ӧ�����ӷ���ʽΪHS��+OH��=S2��+H2O�����Դ��ǣ�HS��+OH��=S2��+H2O��
��5.��NԪ�ص���̬�⻯�ﰱ������һ�ֳ��������˫ԭ�ڷ��ӣ�NO�ܷ�Ӧ���ɵ������÷�Ӧ�����������뻹ԭ���ﶼ�ǵ��������ݵ���ת���غ��֪�����������뻹ԭ��������ʵ���֮��Ϊ��2��0����[0������3��]=2��3�����Դ��ǣ�2��3��
��6.��0.4molҺ̬N2H4������Һ̬H2O2��Ӧ��������̬N2����̬H2O���ų�256.6kJ����������1molҺ̬N2H4��Ӧ�ų�������Ϊ256.6kJ�� ![]() =641.5kJ���ʸ÷�Ӧ���Ȼ�ѧ����ʽΪ��N2H4��l��+2 H2O2��l��=N2��g��+4H2O��g����H=��641.5kJmol��1 ��
=641.5kJ���ʸ÷�Ӧ���Ȼ�ѧ����ʽΪ��N2H4��l��+2 H2O2��l��=N2��g��+4H2O��g����H=��641.5kJmol��1 ��
N2H4�ĵ���ʽΪ ![]() �����Դ��ǣ�N2H4��l��+2 H2O2��l��=N2��g��+4H2O��g����H=��641.5kJmol��1��
�����Դ��ǣ�N2H4��l��+2 H2O2��l��=N2��g��+4H2O��g����H=��641.5kJmol��1�� ![]() ��
��
��7.��ˮ���Ӽ���������H2O�ķе��H2S �е�ߣ����Դ��ǣ��ߣ�ˮ���Ӽ���������
��8.��A��ˮ�������ȶ���������OԪ�طǽ����Ա�S��ǿ��������أ���A����
B����������֮�����������е�ϸߣ�������Һ������B��ȷ��
C������������ˮ����֮���γ������������������ˮ����C��ȷ��
D��ÿ��ˮ��������Χ��4��ˮ����֮���γ�4��������γɡ���϶����ˮ��ɱ����ܶȼ�С���������D��ȷ��
��ѡ��BCD��
��9.���õ���ʽ��ʾ�Ȼ�����γɹ��̣� ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��


 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ��ͭ��ϡ���ᷴӦ������ʵ��װ��ͼ���밴Ҫ��ش����⣺
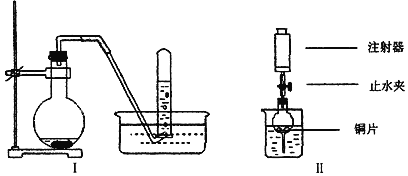
��1��ͭ��ϡ���ᷴӦ�����ӷ���ʽΪ_____________________________________________��
��2��Iʵ��װ�����ܷ�֤��ͭ��ϡ���ᷴӦ���ɵ���NO����_______��ѡ��ܡ����ܡ����� ��������_____________________________��
��3��������ʵ��װ�ý���ʵ�飬��֤��ͭ��ϡ���ᷴӦ���ɵ�������NO�����������ԵIJ�����______________________________________________________________________________��
��4������ʵ��װ�õ��ձ��м���һ�������ϡ���ᣬ��ֹˮ�У���ע����������ȡ������ڵĿ�����ϡ�������Ÿ��������������ֱ��������������ܣ�ֹͣ����ע�������ر�ֹˮ�У���ʱ�۲������ڵ�������________________________________________����Ӧֹͣ��ֹˮ�У���ע������ȡ������ڵ����壨�����ѽ�ע������ԭ�еĿ����Ƴ������ر�ֹˮ�к�ȡ��ע����������ȡһ�����Ŀ�������ʱ�۲쵽��������____________________________________________��
��5������ʵ����ɺ�ע�����ڵ�����ͨ�뵽NaOH��Һ�У���Ŀ����_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ճ�������Ʒ�У���ʹ�õ���Ҫ�������ںϳ���ά���ǣ� ��
A. ����װ B. ��˿�� C. ������ D. ��ë��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����ڿ�ѧ����û�д������( )
A. ���ֿڷ�Һ���������ᡢ���������ʮ��������ı��谱����
B. �������ϲ����κλ�ѧ����
C. ���ִ���ˮ���Դ��������в����κ�����
D. û��ˮ��û������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Na2SO3������70�������ᷴӦ��ȡSO2����ʱ������FeC13��Һ���ն����SO2���塣
��1��д��SO2��FeC13��Һ��Ӧ�����ӷ���ʽ��_____________________________________��
��2��FeC13��Һ����SO2����һ��ʱ�������Һ��һ�����ڵ������У�H+��Fe2+��C1-��SO42-��ijͬ
ѧ��Ϊ�����ܴ����������ӣ�������������ʵ��̽����
������������裺
����1��������HSO3-��SO32-
����2��������Fe3+
����3��HSO3-��SO32-��Fe3+��������
�����ʵ�鷽��
ʵ�鲽�� | ����ͽ��� |
����1��ȡ��������Һ���Թܣ��μ�ϡ�����ữ��Ȼ���ٵ��뼸��___________��Һ�� | ����_________ ���ۣ�����1�������� |
����2��__________ | ����________ ���ۣ�����2������ |
��3���ⶨ������SO2�����ķ����ǣ���500L��SO2����Ŀ���ͨ��20mL��0.00015molKMnO4����Һ�У���ַ�Ӧ������0.02000mol/L��KI��Һ�ζ�������KMnO4������KI ��Һ25.00mL��������е�SO2����Ϊ_________mg/L����5SO2+2MnO4-+2H2O��2Mn2++5SO42-+4H+��10I-+2MnO4-+16H+��2Mn2++5I2+8H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ���ǰ��������仯����֪���л�ѧ��Ӧ���ʱ�
��2HI��g��=H2��g��+I2��g����H1
��SO2��g��+I2��g��+2H2O��g��=H2SO4��l��+2HI��g����H2
��H2SO4��l��=H2O��g��+SO2��g��+ ![]() O2��g����H3
O2��g����H3
��2H2O��g��=2H2��g��+O2��g����H4
��H4���H1����H2����H3֮��Ĺ�ϵ�ǣ���H4= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʳƷ�깺������������Һ����������Ӧʵ�飬�����ܵõ�������������һ�����ԭ���� �� ��
A.���DZ����л�ԭ��
B.���DZ���ԭ
C.ʵ����������Ƿ���ˮ��
D.����������������������в���ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��һ������ѧ�ƣ�����ᡢ����������еĹ�ϵ�������������У�����ȷ����
A.����ʹ��ȼú�������γ���������Ҫԭ��
B.��Ȼ����ú������й©��������ᱬը
C.���û�ѧ��Ӧ��ʵ��12C��14C��ת��
D.���������ڹ�����硢����оƬ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com