
【题目】氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式:
口H2PO2-+口Ag++口________=口PO43-+口Ag+口________
(2)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:
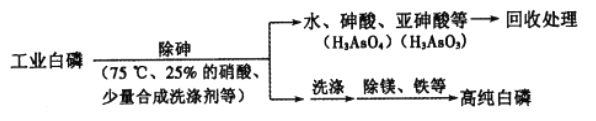
①关于除砷条件的说法合理的是__________(填字母)。
a.75℃使白磷熔化,并溶于水 b.硝酸浓度不易过大,防止白磷反应
c.温度不易过高,防止硝酸分解 d.适当提高温度,加快化学反应速率
②硝酸氧化除砷时被还原为NO,氧化相同质量的砷.当转化为亚砷酸的量越多,消耗硝酸的量越 _____________(填“多”或“少”)。
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如右图,砷的脱除率从a点到b点降低的原因是_____________。

(3)某温度下,已知:
Ag+(aq)+2NH3(aq) ![]() Ag(NH3)2+(aq) k1=1.10×107
Ag(NH3)2+(aq) k1=1.10×107
AgCl(s)![]() Ag+(aq)+Cl-(aq) K2=1.45×10-10
Ag+(aq)+Cl-(aq) K2=1.45×10-10
①反应平衡常数的表达式K1=______________。
②计算可逆反应AgCl(s)+2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。
③1Llmol/L氨水中最多可以溶解AgCl__________mol(保留1位有效数字,忽略溶液体积变化)。
【答案】
(1)lH2PO2-+4Ag++6OH-=lPO43-+4Ag+4H2O
(2)①bcd;②少;③硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷,脱砷率低。
(3)c[Ag(NH3)2+]/c(Ag+).c2(NH3);l.6×l0-3;0.04
【解析】
试题分析:(1)P元素化合价由+1价升高为+5价,共升高4价,而Ag元素由+1价降低为0甲,共降低1价,化合价升降最小公倍数为4,故H2PO2-、HPO43-的系数为1,Ag+、Ag的系数为4,碱性条件下进行反应,结合电荷守恒可知反应物中缺项为OH-,由元素守恒可知生成物中缺项为H2O,平衡后方程式为:1H2PO2-+4Ag++6OH-=1PO43-+4Ag+4H2O,故答案为:1H2PO2-+4Ag++6OH-=1PO43-+4Ag+4H2O;
(3)①a.白磷不溶于水,故a错误;b.硝酸具有强氧化性,硝酸浓度过大,能将白磷溶解,因此硝酸浓度不易过大,故b正确;c.温度过高,硝酸会分解,需要控制合适的温度,故c正确;d.提高温度可以加快反应速率,故d正确;故选:bcd;
②氧化相同质量的砷,转化为亚砷酸的量越多,转移电子数目越小,消耗硝酸越少,故答案为:少;
③硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷,脱砷率低,故答案为:硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷,脱砷率低;
(4)Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq)的平衡常数的表达式K=
Ag(NH3)2+(aq)的平衡常数的表达式K=![]() ,Ag+(aq)+2NH3(aq)
,Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq)与AgCl(s)
Ag(NH3)2+(aq)与AgCl(s)![]() Ag+(aq)+Cl-(aq)相加可以得到:AgCl(s)+2NH3(aq)Ag(NH3)2+(aq)+Cl-(aq),平衡常数表达式K=
Ag+(aq)+Cl-(aq)相加可以得到:AgCl(s)+2NH3(aq)Ag(NH3)2+(aq)+Cl-(aq),平衡常数表达式K=![]() =
=![]() ×c(Ag+)×c(Cl-)=1.10×107×1.45×10-10=1.6×10-3,计算溶解xmolAgCl,则Ag(NH3)2+为xmol/L,Cl-为xmol/L,溶液中NH3(aq)为(1-2x)mol/L,故
×c(Ag+)×c(Cl-)=1.10×107×1.45×10-10=1.6×10-3,计算溶解xmolAgCl,则Ag(NH3)2+为xmol/L,Cl-为xmol/L,溶液中NH3(aq)为(1-2x)mol/L,故![]() =1.6×10-3,解得x=0.04,故答案为:
=1.6×10-3,解得x=0.04,故答案为:![]() ;1.6×10-3;0.04。
;1.6×10-3;0.04。


科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。使用容量瓶前必须进行的一步操作是______________
(2)其操作步骤如下图所示,则如图操作应在下图中的____________(填选项字母)之间。
A.②与③ B.①与② C.④与⑤
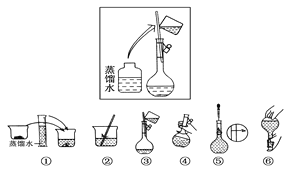
(3)该同学应称取NaOH固体________g
(4)下列操作对所配溶液的浓度大小有何影响?用“偏高”“偏低”或“无影响”填空:
①定容时俯视刻度线: ;
②摇匀后,液面低于刻度线,没有再加水: ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池反应的离子方程式为:Zn+2H+=Zn2++H2↑,则下列说法正确的是
A. HNO3可作电解质溶液 B. 电子从正极沿导线流向负极
C. 锌极质量不变 D. 石墨可作原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-.据此判断,以下叙述错误的是
NH4++NH2-.据此判断,以下叙述错误的是
A.液氨中含有NH3、NH4+、NH2-等粒子
B.一定温度下液氨中c(NH4+)·c(NH2-)是一个常数
C.液氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-)
D.只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质属于常见氧化剂的一组是( )
A. Cl2、O2、FeCl3、KMnO4
B. O2、KMnO4、C、H2
C. Na、K、FeCl2、H2、CO
D. CuO、CO、Fe2O3、H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.SO3+H2O===H2SO4
B.2Na2O2+2H2O===4NaOH+O2↑
C.2F2+2H2O===4HF+O2
D.2Na+2H2O===2NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
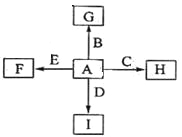
已知:
①反应![]() 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:![]() ,F中E元素的质量分数为60%。
,F中E元素的质量分数为60%。
回答问题:
(1)①中反应的化学方程式为 ;
(2)化合物I的电子式为 ;
(3)C与过量NaOH溶液反应的离子方程式为 ,反应后溶于与过量化合物I反应的离子方程式为 ;
(4)E在I中燃烧观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g)![]() 2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( )
2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( )
A.3 B.5 C.6 D.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热条件下,硅单质和HCl反应生成SiHCl3是粗硅提纯的重要步骤。某小组设计如图所示装置完成上述转化(夹持装置略去)。
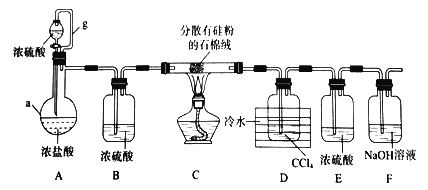
已知:SiHCl3的沸点为33.0°C,易溶于有机溶剂,能与水剧烈反应,在空气中易被氧化,CCl4的沸点为76.8°C。请回答:
(1)仪器a的名称为 ;导管g的作用为 ;
(2)装置A中,浓硫酸体现的性质为 ;实验时,需先打开分液漏斗活塞,一段时间后,在点燃C处酒精灯,理由是 ;
(3)装置C中发生反应的化学方程式为 ;
(4)装置D中所得的液态混合物的分离方法为 。(填操作名称)
(5)反应后的气体通过装置F中的NaOH溶液后,对逸出气体的处理方法为 ;
(6)SiHCl3在潮湿的空气中被氧化,生成一种氧化物和一种无氧酸,该反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com