
分析 利用盖斯定律分析,不管化学反应是一步或分几步完成,其反应热是不变的;根据目标方程改写分方程,然后求出反应热.
解答 解:①H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)═$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S(g)+$\frac{1}{2}$O2(g)═S(g)+H2O(g)△H3
④2S(g)=S2(g)△H4
根据目标方程,把方程③反写,计量数乘以2;把方程②乘以$\frac{2}{3}$;把方程①乘以$\frac{2}{3}$;然后三者相加;即-△H3×2+△H2×$\frac{2}{3}$+△H1×$\frac{2}{3}$=$\frac{2}{3}$(△H1+△H2-3△H3),
故选A.
点评 本题考查了盖斯定律的应用,要注意方程式计量数的变化,及△H的符号的变化,掌握基础是解题关键,题目难度中等.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
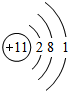 它的电子数为11,在化学反应中容易失去1 个电子成为Na+ (离子符号)
它的电子数为11,在化学反应中容易失去1 个电子成为Na+ (离子符号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | KNO3 | C. | MgSO4 | D. | AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
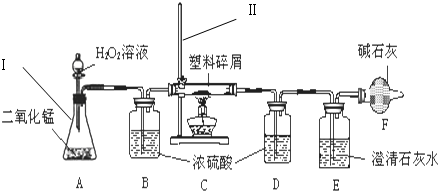
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com