
����Ŀ�������ʽṹ�����ʡ��ѱ���Ϊ�������������������������������Ҫ�Ľṹ���ϡ�
(1)��̬��ԭ�ӵĺ�������Ų�ʽ�� ��
(2)���ʯ(TiO2)���۵�1825���������η�ֱ�ӵ����ʯ�ɻ�ý����ѣ����ʯ�����ľ��������� ���塣
(3)TiCl4����NH4Cl��Ӧ���������(NH4)2[TiCl6]��
����������У��γ���λ��ʱ�ṩ�¶Ե��ӵ��� ��(��Ԫ�ط���)
����NH4����Ϊ�ȵ������һ��������Ϊ ��(�ѧʽ)
(4)TiO2+��H2O2��ϡ���з�Ӧ�����ٺ�ɫ��[TiO(H2O2)]2+���ӣ��������ѵĶ��Լ��顣���й���H2O2��˵����ȷ���� ��(�����)
A���ռ乹��Ϊֱ���� |
B�����Ǽ��Լ��ļ��Է��� |
C��Oԭ�ӹ���ӻ�����Ϊsp3 |
D����ѧ���ʲ��ȶ�����Ϊ����ļ��ܽ�С |
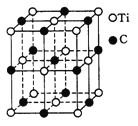
(5)�������һ������(Ti)ԭ�Ӻ�̼ԭ�ӹ��ɵ���̬�Ŵط��ӣ��ṹģ����ͼ��ʾ�����ķ���ʽΪ ��
���𰸡�(1)1s22s22p62s23p63d24s2��[Ar]3d24s2
(2)���� (3)BH4-(4)BC (5)Ti14C13
�����������������(1)��ԭ�ӵĺ˵����Ϊ22�����̬��ԭ�ӵĺ�������Ų�ʽ��1s22s22p62s23p63d24s2��[Ar]3d24s2��
(2)���ʯ(TiO2)���۵�1825���������η�ֱ�ӵ����ʯ�ɻ�ý����ѣ�˵�����۵��Ҹ������ܷ������룬��֪���ʯΪ���Ӿ��塣
(3)�������(NH4)2[TiCl6]�У�N��Clԭ�Ӿ��й¶Ե��ӣ���������ԭ��Ti�γ���λ����
���ȵ�������ָ������ͬ������Ŀ��ԭ����Ŀ�ķ��ӻ����ӣ�NH4+�е�����Ϊ��7+4-1=10��ԭ����Ϊ5������BH4-��֮��Ϊ�ȵ�����������ӣ�
(4)A��H2O2��������ԭ���γ�2������������2�Թµ��Ӷԣ�Oԭ�Ӽ������ӵ�Hԭ�ӡ�Oԭ���γ�V�νṹ��H2O2���ӵĿռ乹�Ͳ���ֱ���Σ�Ϊչ����ҳ�νṹ����A����B��H2O2�����к���O��O�Ǽ��Լ���O��H���Լ��ļ��Է��ӣ���B��ȷ��C��H2O2������Oԭ�ӹ���ӻ�����Ϊsp3����C��ȷ��D������ֻӰ���������ʣ���Ӱ�컯ѧ���ʣ���D����ΪBC��
(5)��������֪��ͼ���ṹ��������ӽṹ�������к��е�ԭ�Ӿ����仯ѧʽ�к��е�ԭ�ӣ�ֱ���������е�Tiԭ�Ӻ�Cԭ�Ӹ������ɣ������ʽΪTi14C13��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
A. �Ҵ�����ϩ��ֲ���Ͷ���ʹ���Ը��������Һ��ɫ
B. �Ҵ������顢���ᶼ�������Ʒ�Ӧ��������
C. ��ϩ��ʹ���Ը��������Һ��ɫ
D. ����������ζ�ķ����������ִ���֯��ʹ�ë֯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ǣ� ��
A. ����Ũ���ᡢŨ���Ṳ�Ȳ�����55��60����Ӧ����������
B. ����ϩ�ں��������´�����������һ�������
C. ��ϩ��������Ȼ�̼��Һ��Ӧ����1,2-��������
D. �ױ��������ڹ����·�Ӧ��Ҫ����2,4-���ȼױ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺
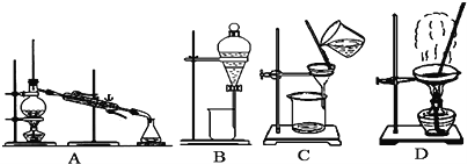
��1��д��ͼ�б���ŵĶ�Ӧ�������ƣ���_________________����_______________����������ˮ������Ϊ___________(��Ͻ��³����� ���½��ϳ���)
��2��ѡ����ʵ�ʵ�鷽���������л����ô�������װ�õ���ĸ��գ�
�ٴ��Ȼ�����Һ�еõ��Ȼ��ع��壬ѡ��װ��____________��
�ڷ��뱥��ʳ��ˮ��ɳ�ӵĻ���ѡ��װ��____________��
�۳�ȥ����ˮ�е�Cl-����������ȡ����ˮ��ѡ��װ��____________��
�ܷ����Ҵ���ˮ�Ļ���ѡ��װ��________��
�ݷ������ͺ�ˮ�Ļ���ѡ��װ��____________��
��3��������ˮ�Ļ�����ѡ�����������Լ���_______(�����)�����÷��뷽��Ϊ________��
A�����Ȼ�̼ B���Ҵ� C������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��ͬѧͨ������������ȡ������ˮ��ϡ����ĻƼ������[KNH4Fex(SO4)y(OH)z]����ͨ��ʵ��ⶨ��Ʒ�лƼ���������й���ɡ�

ʵ��ⶨ��
����ȡһ����������Ʒ����ϡ�����г���ܽ⣬��������Һת��������ƿ�����Ƴ�l00mL��ҺA��
����ȡ25.00mL��ҺA�����������ữ��BaCl2��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����9.32g��
����ȡ25.00mL��ҺA����������KI����2.000mol��L��1Na2S2O3��Һ���еζ�(��֪��ӦΪI2+2Na2S2O3�T2NaI+Na2S4O6������30.00mL Na2S2O3��Һ���յ㡣
(1)��[KNH4Fex(SO4)y(OH)z]��x��y��z�Ĵ�����ϵʽΪ ��
(2)������H2SO4��pH����Ϊ2������Һc(Fe3+)ӦΪ mol��L��1��(��֪Ksp[Fe(OH)3]��4.0��10��38)
(3)ʵ��ⶨ���м�������Ƿ���ȫ�ķ����� ��
(4)��������ʵ�����ݼ�����Ʒ�е�n(Fe3+)��n(SO42��)��(д���������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ԭ�Ӿ�����ֻ���ڹ��ۼ�
B. �ǽ���Ԫ���γɵĻ����ﲻ���γ����Ӿ���
C. �ɱ�����ʱ�������ڹ��ۼ��ᷢ������
D. ����Ԫ�غͷǽ���Ԫ���γɵĻ�����һ�������ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ȷ����
A. �ζ�ǰ�ô���Һ��ϴ��ƿ
B. ����ƿ�͵ζ���ʹ��ǰ����Ҫ��©
C. �������ʱ���ȹر�����ˮ����ֹͣ����
D. ��Һʱ���²���Һ�ȴ��¿ڷų����ϲ���Һ�ٴ��Ͽڵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ի�����Ϊԭ��������������������к�Fe2O3��SiO2��Al2O3��MgO�������������Ʊ�����(Fe2O3)�Ĺ���������

��1�����ܹ�����Fe2O3��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ ��������A����Ҫ�ɷݵĻ�ѧʽΪ ��
��2����ԭ�����м���FeS2��Ŀ���ǽ���Һ�е�Fe3 +��ԭΪFe2 +��������������ΪH2SO4������ɸ÷�Ӧ�����ӷ���ʽ��FeS2 + 14Fe3 + + H2O=15Fe2 + + SO42- + ��
��3�����������У�O2��NaOH��Fe2+��Ӧ�����ӷ���ʽΪ ��
��4��Ϊ��ȷ�����������������������Ҫ������Һ��pH�ķ�Χ�� (�������ӳ�����pH���±�)����ҺB���Ի��յ�������(д��ѧʽ)________________��
������ | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
��ʼ����pH | 2.7 | 3.8 | 7.6 | 9.4 |
��ȫ����pH | 3.2 | 5.2 | 9.7 | 12.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Ħ����ʹ����ȷ���ǣ� ��
A��1mol O������Ϊ16g��mol��1
B��0.5mol HeԼ����6.02��1023������
C��2H�ȱ�ʾ2����ԭ���ֱ�ʾ2mol��ԭ��
D��ÿĦ�����ʾ�����6.02��1023��ԭ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com