
����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ���±���
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
T | �������������ڲ����������4 |
X | �����������Ǵ�����������2�� |
Y | �����γɵ���̬�������ڱ�״���µ��ܶ�Ϊ0.76g��L-1 |
Z | Ԫ����������븺�۵ľ���ֵ֮����6 |
��1��Ԫ��X��һ��ͬλ�ؿɲⶨ�������������ͬλ�صķ����� �������ڱ��е�λ���� ��
��2��Ԫ��Y����Ԫ���γ�һ������YH4����д����������Z�����γɻ�����ĵ���ʽ ��
��3��д��Ԫ��X��T�γɵĻ�����XT2�ĵ���ʽ ��
��4��Ԫ��Z��Ԫ��T��ȣ��ǽ����Խ�ǿ���� ����Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ���� ������ţ���
a��������Z�ĵ��ʺ�T�ĵ���״̬��ͬ
b��Z���⻯���T���⻯���ȶ�
c��һ��������Z��T�ĵ��ʶ���������������Һ��Ӧ
d���������ȣ�Z������������T���ɶ�����
e��Tԭ����Zԭ�ӵ��Ӳ�����ͬ��Zԭ�Ӱ뾶С��Tԭ��
��5��T�ĵͼ�������ͨ��Z���ʵ�ˮ��Һ�У�������Ӧ�Ļ�ѧ����ʽΪ ��
��6���ֱ��õ���ʽ��ʾZ��þԪ�ء�Y�뵪Ԫ���γɻ�����Ĺ���: ��
���𰸡���1��146C �ڶ�����IVA��
��2��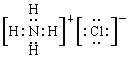
��3��![]()
��4��Cl b��d��e
��5��SO2+Cl2+2H2O��2HCl+H2SO4
��6��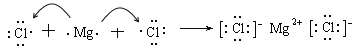
![]()
�����������������Tԭ���������������ڲ����������4����T�ǵ������ڵ�S��Xԭ�������������Ǵ�����������2�������X�ǵڶ����ڵ�C��Y�����γɵ���̬�������ڱ�״���µ��ܶ�Ϊ0.76g��L-1������Է���������0.76��22.4��17����Y��N��ZԪ����������븺�۵ľ���ֵ֮����6����Z��Cl��
��1��̼Ԫ�ص�ԭ��������6��λ�ڵڶ�����IVA�壬�ɲⶨ�������ͬλ�صķ�����146C��
��2��Ԫ��N����Ԫ���γ�һ������NH4�������������������γɻ��������Ȼ�泥��������ӻ��������ʽΪ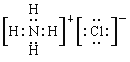 ��
��
��3��Ԫ��X��T�γɵĻ�������CS2�����й��ۼ��Ĺ��ۻ��������ʽΪ![]() ��
��
��4��ͬ�����������ҷǽ���������ǿ������Ԫ�صķǽ�����ǿ��SԪ�أ�a���ǽ�����ǿ���뵥��״̬û�й�ϵ��a����B���ǽ�����Խǿ���⻯��Խ�ȶ�����Z���⻯���T���⻯���ȶ�����˵���ǽ�����ǿ����b��ȷ��c��һ��������Z��T�ĵ��ʶ���������������Һ��Ӧ��ǽ�����ǿ��û�й�ϵ��c����d���������ȣ�Z������������T���ɶ���������˵����Ԫ�صķǽ�����ǿ�ڣ�d��ȷ��e��Tԭ����Zԭ�ӵ��Ӳ�����ͬ��Zԭ�Ӱ뾶С��Tԭ�ӣ�ͬ������������ԭ�Ӱ뾶��С���ǽ���������ȷ��e��ȷ����ѡbde��
��5�������ܰѶ���������������T�ĵͼ��������������ͨ��Z���ʵ�ˮ��Һ��ˮ�У�������Ӧ�Ļ�ѧ����ʽΪSO2+Cl2+2H2O��2HCl+H2SO4��
��6���Ȼ�þ�Ǻ������Ӽ������ӻ�������γɹ��̿ɱ�ʾΪ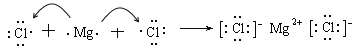 �������Ǻ��м��Լ��Ĺ��ۻ�������γɹ��̿ɱ�ʾΪ
�������Ǻ��м��Լ��Ĺ��ۻ�������γɹ��̿ɱ�ʾΪ![]() ��
��


 ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F��G��I��Ϊǰ������ԭ���������������Ԫ�ء�Aԭ�ӵ�L���Ӳ��p�ܼ�����һ���չ����C���������6���˶�״̬��ͬ���ӣ�D�Ļ�̬ԭ����Χ�����Ų�ʽΪ3S2��E��Dͬ���ڣ����ڸ������е縺�����F��G��ͬ����ԭ��������2��Ԫ�أ�I�Ļ�̬ԭ����Χֻ��һ�������ӡ�
��1�� ���й���A2H4���Ӻ�H2C2���ӵ�˵����ȷ���� ��
A�������ж��������������� B������ԭ�Ӷ�sp2�ӻ�
C�����Ǻ����Լ��ͷǼ��Լ��ķǼ��Է���
D����Ϊ�ȵ����� E��A2H4���ӵķе����Ե���H2C2����
��2��A��B��C����Ԫ���е����֣����γ�ԭ�Ӹ�����Ϊl��3�ij��������Ʋ����������Ŀռ乹��Ϊ ��
��3��E���γɶ��ֺ����ᣬ��HEO3��HEO2�����������HEO3����HEO2��ԭ�� ��
��4�� G��AC���γɻӷ���Һ��G(AC)4������������� ���塣
��5�� F��������ṹΪ���������ѻ���ԭ�Ӱ뾶Ϊa nm��I��������ṹΪ���������ѻ���ԭ�Ӱ뾶Ϊb nm�������ֽ������ܶȱ�Ϊ (�ú�a��b����ʽ��ʾ)��
��6�� ��֪Ti3�����γ���λ��Ϊ6����ɫ��ͬ����������ᄃ�壬һ��Ϊ��ɫ����һ��Ϊ��ɫ�����־������ɽ�ΪTiCl3��6H2O��Ϊ�ⶨ�����־���Ļ�ѧʽ�����������ʵ�飺
a���ֱ�ȡ����������������ᄃ�����Ʒ��ɴ�����Һ��
b���ֱ���������Һ�е���AgNO3��Һ����������ɫ������
c��������ȫ��ֱ���˵����ݳ�������ϴ�Ӹ�������������ԭ��ɫ�����ˮ��Һ�õ��İ�ɫ��������Ϊԭ��ɫ�����ˮ��Һ�õ��ij���������2/3������ɫ���������Ļ�ѧʽΪ________________����Cl�����γɵĻ�ѧ��������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��TiCl4�����������Ѻ��Ѱ�ԭ�ϣ���ҵ����Ҫ��TiO2�Ȼ��ķ�������ȡ��ij��ѧʵ��С����8.0g TiO2������ CCl4Ϊԭ����ȡTiCl4��װ��ͼ���£�
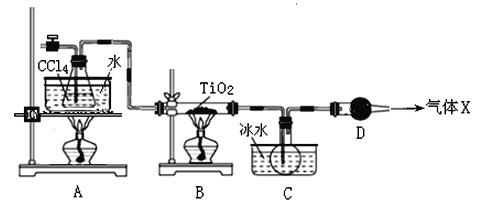
�±����й����ʵ����ʣ�
���� | �۵�/�� | �е�/�� | ���� |
CCl4 | ��23 | 76.8 | ��TiCl4���� |
TiCl4 | ��25 | 136 | ����ʪ������������ |
��ش���������
��1��TiCl4�л�ѧ���������� ��
��2��B��TiO2������Ӧ�Ļ�ѧ����ʽ�� ��
��3��X�������Ҫ�ɷ��� ��
��4��ʵ�鿪ʼʱ�ȵ�ȼA���ľƾ��ƣ���C����ƿ����Һ�γ���ʱ�ٵ�ȼB���ľƾ��ƣ�����ҪĿ���� ��
��5��������Cװ���е�TiCl4��Ӧ���õ�ʵ�����Ϊ ����������ƣ���
��6��������Ӧ���������ɵ�����Xȫ��ͨ�뵽��ͼ��ʾ��װ���г�ַ�Ӧ�����ɵ����� ���ѧʽ���������ε������ʵ���n�� ��
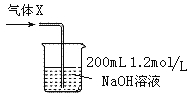
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС�������ͼʾʵ��װ��(ͼ��ʡ���˼г�����)���ⶨij��̼�Ͻ�����������������
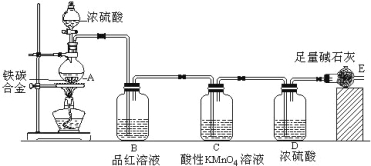
��1��m g��̼�Ͻ��м������Ũ���ᣬδ��ȼ�ƾ���ǰ��A��B��������������ԭ���ǣ�
��������̼��Ũ�����Ӧ���� ��
��2��д������ʱA��̼��Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽ ��
��3��Cװ�õ����� ��
��4����С��ͬѧ��Ƶ�ʵ��װ�ô���ȱ�ݣ��йظ�ʵ��װ�ü�ʵ������У��������ؿ��ܻᵼ����������������ֵƫ�͵��� ��
A��A�з�Ӧ����ȫ
B��E�м�ʯ�һ����տ����е�CO2��H2O
C����Ӧ���ɵ�SO2���ֱ�E�м�ʯ������
D����Ӧ��ȫ����CO2����������װ����ϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������о����֣��ø�Ĥ��ⷨ������Ũ����ȩ��ˮ���й������̼���Ľϵ͵��ŵ㣬��ԭ����ʹ��ȩ�ֱ�����������������Ӧ��ת��Ϊ�Ҵ������ᣬ�ܷ�ӦΪ��2CH3CHO + H2O![]() CH3CH2OH + CH3COOH
CH3CH2OH + CH3COOH
ʵ�����У���һ��Ũ�ȵ���ȩ��Na2SO4��ҺΪ�������Һ��ģ����ȩ��ˮ�Ĵ������̣���װ��ʾ��ͼ����ͼ��ʾ��
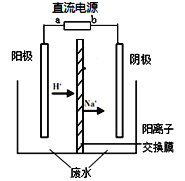
��1�����Լ���ȼ�ϵ��Ϊֱ����Դ����ȼ�ϵ����b��Ӧͨ�� ���ѧʽ�����塣
��2���������У��������ֱ�����������Ҵ��⣬��������ɫ���塣�缫��Ӧ���£�
�������� 4OH����4e����O2��+2H2O
�� ��
�������� ��
��CH3CHO+2e��+2H2O��CH3CH2OH+2OH��
��3���������У�������Na2SO4�����ʵ��� ������������������С����������������
��4���������У�ijʱ�̲ⶨ����������Һ�и���ֵ����ʵ���������Na2SO4��CH3COOH�����ʵ�����ͬ�����й�����������Һ�и���Ũ�ȹ�ϵ��˵����ȷ���� ������ĸ��ţ���
a. c(Na+)��һ����c(SO42��)��2��
b. c(Na+)��2c(CH3COOH)+2c(CH3COO��)
c. c(Na+)+c(H+)��c(SO42��)+c(CH3COO��)+c(OH��)
d. c(Na+)��c(CH3COOH)��c(CH3COO��)��c(OH��)
��5����֪����ȩ���Ҵ��ķе�ֱ�Ϊ20.8����78.4�����ӵ�������������Һ�з�����Ҵ���Ʒ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��ǰ������ԭ�������������������Ԫ�ء�AԪ��ԭ�ӵĺ����������������Ӳ�����BԪ�ػ�̬ԭ���������ܼ��Ҹ��ܼ���������ͬ�� A��D���γ����ֳ���Һ̬������G��H����ԭ����֮�ȷֱ�Ϊ1:1��2:1��EԪ��ԭ�ӵ�K��L�������֮�͵�����M��N�������֮�͡���ش����и��⣨�漰Ԫ��������Ӧ��ѧ���ű�ʾ����
��1�� B��C��D����Ԫ���е縺������Ԫ�����̬ԭ�ӵĵ����Ų�ͼΪ ��
��2������һ���ռ��˶�״̬�ĵ�����ԭ�Ӻ�����ֵĸ����ܶȷֲ����� ������������B�Ļ�̬ԭ���У�������� �������෴�ĵ��ӡ�
��3����E��D�γɵľ�����ͼ1��ʾ��������E2+��Χ�Ⱦ��������E2+��________����ED����ɫ��ӦΪש��ɫ��������������ǵĻ����ﶼ���Է�����ɫ��Ӧ����ԭ���� ��E��B���γɵľ���ľ����ṹ��NaCl��������ƣ���ͼ2��ʾ�������þ����к��е�������B22���Ĵ��ڣ�ʹ������һ������������������E2+����λ��Ϊ______���û�����ĵ���ʽΪ ��

��4���ø�����������Һ̬Hʱ��һ��H�������ͷų�һ�����ӣ�ͬʱ����һ�������ӡ�
���ͷų����ĵ��ӿ��Ա�����H�����γɵ���������������ΪH���Ӽ����γ���������ԭ���� ��
����H�����ͷų�һ������ʱ������һ�������Ӿ��н�ǿ�������ԣ���д������������SO2��ˮ��Һ��Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���ɱ��ݻ����ܱ�������ͨ��N2��H2��������Ӧ��N2(g)��3H2(g)![]() 2NH3(g) ��H��0�ﵽƽ������������Ϊ4L���Իش��������⣺
2NH3(g) ��H��0�ﵽƽ������������Ϊ4L���Իش��������⣺
��1���������£���Ӧ��ƽ�ⳣ������ʽK �� ���������¶ȣ�Kֵ�� ������������������С����������������
��2���ﵽƽ����������������䣬�����������Сһ�룬ƽ�⽫___���������淴Ӧ����������������Ӧ�����������������ƶ���ƽ�ⳣ��K�� ����������������С����������������������___________________________��
��3�� �ﵽƽ����ں�ѹ�����£���������ͨ�뺤��(He)��������ת���ʽ�________������������������С����������������
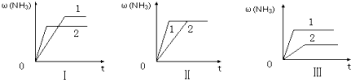
��4����������ͬ�������и�����1 molN2��3molH2���ڲ�ͬ�����·ֱ�ﵽƽ�⣬���������������ʱ��仯��ͼ������˵����ȷ���� ������ţ���
a��ͼ�������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P2��P1
b��ͼ��������ͬ��ͬѹ�´����Է�Ӧ��Ӱ�죬�Ҵ�����1��2
c��ͼ�������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1��T2
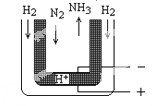
��5����ѹ�£���H2����Heϡ�͵�N2�ֱ�ͨ��һ��570���ĵ���װ�ã���ͼ����H2��N2����ڵ缫�Ϻϳɰ���װ���еĵ���ʣ�ͼ�к�ϸ�㴦���ܴ���H+���������ĵ缫��ӦʽΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����t��ʱAgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ��t��ʱAgCl��Ksp��4��10��10������˵������ȷ����
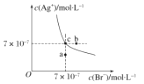
A����t��ʱ��AgBr �� KspΪ4.9��10��13
B���� t ��ʱ��AgCl(s)��Br��(aq)![]() AgBr(s)��Cl��(aq)��ƽ�ⳣ�� K��816
AgBr(s)��Cl��(aq)��ƽ�ⳣ�� K��816
C��ͼ��a���Ӧ����AgBr�IJ�������Һ
D���� AgBr ������Һ�м���NaBr���壬��ʹ��Һ��c��䵽b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��¿��淴Ӧ��A(s)+2B(g)![]() 2C(g)+D(g)����H>0���ֽ�1molA��2molB����������У���4 molC��2 mol D�����������У���ʱ���ƻ���P��ʹ�ҵ��ݻ�Ϊ��2����t1ʱ�������ھ��ﵽƽ��״̬(��ͼ1��ʾ������K�����ƶ�)������˵����ȷ����
2C(g)+D(g)����H>0���ֽ�1molA��2molB����������У���4 molC��2 mol D�����������У���ʱ���ƻ���P��ʹ�ҵ��ݻ�Ϊ��2����t1ʱ�������ھ��ﵽƽ��״̬(��ͼ1��ʾ������K�����ƶ�)������˵����ȷ����

A�������¶Ⱥͻ���λ�ò��䣬�ڼ����ټ���1 mol A��2 mol B���ﵽ�µ�ƽ�����C��Ũ��������C��Ũ�ȵ�2��
B�����ֻ���λ�ò��䣬�����¶ȣ��ﵽ�µ�ƽ��ס�����B���������������
C�������¶Ȳ��䣬�ƶ�����P��ʹ�ҵ��ݻ��ͼ���ȣ��ﵽ�µ�ƽ�������C����������Ǽ���C�����������2��
D�������¶Ⱥ����е�ѹǿ���䣬t2ʱ�ֱ���ס����м���������ĺ����ס����з�Ӧ���ʱ仯����ֱ���ͼ2��ͼ3��ʾ(t1ǰ�ķ�Ӧ���ʱ仯��ʡ��)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com