
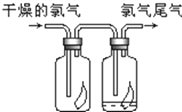
 (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式,并用双线桥画出电子转移的方向和数目.
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式,并用双线桥画出电子转移的方向和数目.
分析 (1)实验室用浓盐酸和二氧化锰制取氯气,二者反应生成氯化锰、氯气和水,锰元素化合价+4价降低为+2价,氯元素化合价-1价变化为0价,结合电子守恒标注;
(2)氯气无漂白性,氯气与水反应生成的次氯酸具有漂白性;
(3)氯气和消石灰反应生成氯化钙、次氯酸钙和水;漂白粉有效成分为次氯酸钙,该反应中氧化剂与还原剂都是氯气,化合价0甲变化为-1价做氧化剂,化合价变化为+1价做还原剂;
(4)①氯气和氨气发生氧化还原反应生成氮气和氯化铵,氯元素化合价0价变化为-1价,氮元素化合价-3价变化为0价,结合电子守恒和原子守恒配平书写得到化学方程式
②3Cl2+8NH3=N2+6NH4Cl,反应中有化合价变化,属于氧化还原反应,氯元素化合价降低,表现氧化性,生成的氯化氢与氨气极易反应生成氯化铵,氯化铵常温下为白色固体,结合复分解、置换反应的定义解答.
解答 解:(1)Mn元素的化合价由+4价降低为+2价,Cl元素的化合价由-1价升高为0,该反应中转移2e-,用双线桥表示该反应电子转移方向和总数为: ,
,
故答案为: ;
;
(2)氯气无漂白性,氯气与水反应生成的次氯酸具有漂白性,干燥的有色布条无明显现象,潮湿的有色布条褪色;
故答案为:干燥的有色布条无明显现象,潮湿的有色布条褪色;
(3)氯气和氢氧化钙反应生成氯化钙、次氯酸钙、水;其化学方程式为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;漂白粉的有效成分是:Ca(ClO)2 ,该反应中氧化剂与还原剂都是氯气,化合价0甲变化为-1价做氧化剂,化合价变化为+1价做还原剂,则氧化剂和还原剂物质的量之比是1:1,
故答案为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;Ca(ClO)2;1:1;
(4)①工业上利用反应氯气和氨气反应生成氮气和氯化铵检查氯气管道是否漏气,氯元素化合价0价变化为-1价,氮元素化合价-3价变化为0价,结合电子守恒和原子守恒配平书写得到化学方程式为:3Cl2+8NH3=N2+6NH4Cl,
②A.反应生成氯化铵,观察到白烟可知管道漏气,故A正确;
B.反应中有化合价变化,属于氧化还原反应,氯元素化合价降低,表现氧化性,故B正确;
C.反应中有单质参加和生成,不属于复分解反应,故C错误;
D.反应符合一种单质和一种化合物反应生成另一种单质和另一种化合物的特点,为置换反应,故D正确;
故选ABD,
故答案为:3,8,1,6;ABD.
点评 本题考查了氯气的制备和性质、氧化还原反应电子转移和配平,明确氯气制备原理及氯气和次氯酸性质的区别是解题关键,注意漂白粉的主要成分与有效成分的区别,注意漂白粉漂白的原理,题目难度中等.


科目:高中化学 来源: 题型:实验题
| 软锰矿 | 闪锌矿 |
| MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分 | ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分 |
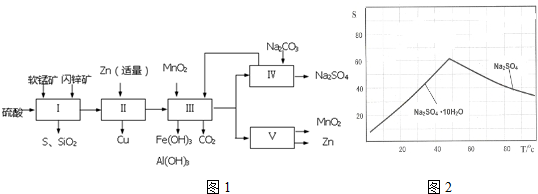
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 7.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Fe(SO4)2加入过量NaOH溶液中::NH4++Fe3++4OH-═NH3•H2O+Fe(OH)3↓ | |
| B. | 次氯酸钠溶液中通入过量的二氧化硫:ClO-+SO2+H2O═HSO3-+HClO | |
| C. | Ba(OH)2溶液和稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 澄清的石灰水中加入过量的NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
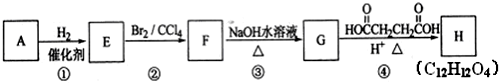
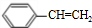 +Br2→
+Br2→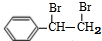
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③ | C. | ①②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com