
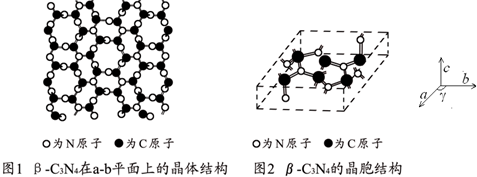
分析 图为切片层状结构中菱形内为层内重复结构单元,含有6个C原子、8个N原子,N原子以2个双键和一个单键连接,西格玛电子对数为3,孤电子对数为0,价层电子对数为3,据此判断杂化类型,实验测得此晶体结构属于六方晶系,晶胞结构图示原子都包含在晶胞内,计算晶胞质量、晶胞体积,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:硬度比金刚石还大,属于原子晶体,图为切片层状结构中菱形内为层内重复结构单元,含有6个C原子、8个N原子,C、N原子数目之比为3:4,N原子以2个双键和一个单键连接,西格玛电子对数为3,孤电子对数为0,价层电子对数为3,故杂化轨道类型为sp2,实验测得此晶体结构属于六方晶系,晶胞质量=$\frac{6×12+8×14}{6.02×1{0}^{23}}$g,晶胞参数a=0.64nm,c=0.24nm,则晶胞体积为(0.64×10-7 cm)2×sin120°×0.24×10-7 cm,故晶胞密度$ρ=\frac{12×6+14×8}{{6.02×{{10}^{23}}×[{{(0.64×{{10}^{-7}})}^2}×sin{{120}°}×0.24×{{10}^{-7}}]}}=3.6g•c{m^{-3}}$,
故答案为:sp2;6;$ρ=\frac{12×6+14×8}{{6.02×{{10}^{23}}×[{{(0.64×{{10}^{-7}})}^2}×sin{{120}°}×0.24×{{10}^{-7}}]}}=3.6g•c{m^{-3}}$.
点评 本题主要考查物质结构与性质,涉及杂化方式、晶胞计算等,需要学生具备一个的空间想象与数学计算能力,题目难度较大.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中充入1 mol N2和3 mol H2,充分反应后生成NH3的分子数目为2NA | |
| B. | 标准状况下,44.8 L氮气所含的共用电子对数目为2NA | |
| C. | 常温常压下,1 mol NaHSO4固体中含有的离子数目为2NA | |
| D. | 1 mol Fe与71 g Cl2充分反应后转移的电子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.4mol/(L•s) | B. | v(C)=30mol/(L•min) | C. | v(B)=0.4mol/(L•min) | D. | v(A)=0.15mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含4molHCl的浓盐酸与足量MnO2混合加热,产生NA个Cl2 | |
| B. | 氧气和臭氧组成的4.8g混合气体中含有0.3 NA个氧原子 | |
| C. | 标准状况下,2.24L SO3含有分子的数目为0.1NA | |
| D. | 1mol 硫酸氢钠溶液中含有阳离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
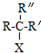 $\stackrel{NaOH/H_{2}O}{→}$
$\stackrel{NaOH/H_{2}O}{→}$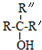 (X为卤素原子,R,R′,R″均为烃基或H原子)
(X为卤素原子,R,R′,R″均为烃基或H原子)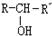 $\stackrel{O_{2}/Ag}{→}$
$\stackrel{O_{2}/Ag}{→}$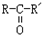 ,
,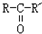 $\stackrel{H_{2}/Ni}{→}$
$\stackrel{H_{2}/Ni}{→}$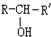
 ; D的结构简式是O=C(CH3)COOH.
; D的结构简式是O=C(CH3)COOH. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
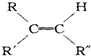 $→_{②Zn/H_{2}O}^{①O_{3}}$
$→_{②Zn/H_{2}O}^{①O_{3}}$ +
+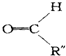 .
.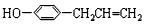 ,C
,C ,E
,E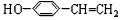 .
.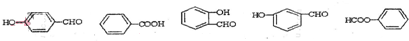 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com