
| 元素A | s电子总数是p电子总数的2倍 |
| 元素C | 某种核素原子的质量数为18,中子数为10 |
| 元素X | 单质是良好的半导体材料 |
| 元素Y | 其单质为淡黄色晶体,常用来处理打碎的水银温度计 |
| 元素Z | 3d能级上有4个未成对电子 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、TNT的结构简式为: |
B、苯乙醛的结构简式为: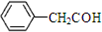 |
C、丙烷分子的球棍模型为: |
| D、乙烯的结构简式为:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、测定酸碱滴定曲线实验所用玻璃仪器有酸式滴定管、碱式滴定管、锥形瓶、烧杯 |
| B、除去乙酸乙酯中混有的乙酸采用加入饱和NaOH溶液后进行分液的方法 |
| C、除去粗盐中不溶性杂质的操作有溶解、过滤、蒸发 |
| D、石蜡油蒸气在炽热碎瓷片的作用下分解产生的气体可使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com