
| m |
| V |
| m |
| V |
| m1 |
| ρ1 |
| 2kg |
| ρ1 |
| m2 |
| ρ2 |
| 4kg |
| ρ2 |
| 2kg |
| ρ1 |
| 4kg |
| ρ2 |
| m总 |
| V总 |
| 6kg | ||||
|
| 3ρ1ρ2 |
| ρ2+2ρ1 |
| 3ρ1ρ2 |
| ρ2+2ρ1 |


科目:高中化学 来源: 题型:
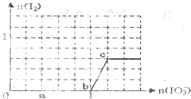 已知:还原性还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )| A、反应过程中的氧化产物均为SO3 |
| B、a点时剩余NaHSO3的物质的量为1.2 mol |
| C、b点时的还原产物可能是KI或NaI |
| D、当溶液中I-与I2的物质的量之比为1:1时,加入的KIO3为1.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| V(NaOH) | V(KHP)平均 |
| 20.00mL | 18.00mL |
| V(稀释后的醋) | V(NaOH)平均 |
| 18.00mL | 20.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
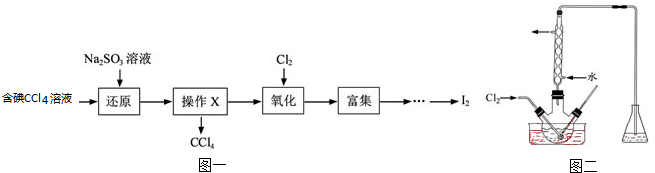
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g?L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
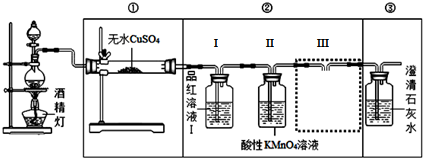
| 实验装置 | ① | ② | ③ |
| 实验现象 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实 验 组 | 温 度 /℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O(g) | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
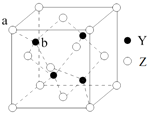 元素X是地壳中含量最多的元素;元素Y基态原子的3p 轨道上有4个电子;元素Z 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
元素X是地壳中含量最多的元素;元素Y基态原子的3p 轨道上有4个电子;元素Z 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.查看答案和解析>>
科目:高中化学 来源: 题型:
| 在微生物作用下 |
| O2/H2O |
| 在微生物作用下 |
| O2/H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当溶液中c(CH3COO-)=c (Na+)>c (H+)=c(OH-)时,一定是醋酸过量 |
| B、当溶液中c (CH3COO-)=c (Na+)时,一定是氢氧化钠过量 |
| C、当溶液中c (CH3COO-)=c (Na+)时,醋酸与氢氧化钠恰好完全反应 |
| D、当溶液中c (Na+)>c (CH3COO-)>c (OH-)>c (H+)时,一定是氢氧化钠过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com