
| A. | 常温下,浓度均为0.2mol•L-1的NaHCO3和Na2CO3溶液中,都存在电离平衡和水解平衡,分别加入NaOH固体恢复到原来的温度,c(CO32- )均增大 | |
| B. | 已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol•L-1的NaA和NaB混合溶液中,c(Na+)>c(B-)>c(A-)>c( OH-)>c(HA)>c(HB)>c(H+) | |
| C. | pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,其浓度:c(CH3COONa)>c(C6H5ONa)>c( Na2CO3)>c(NaOH) | |
| D. | 一定温度下,pH相同的溶液,由水电离产生的c(H+)相同 |
分析 A.氢氧化钠抑制了碳酸根离子的水解,碳酸氢钠与氢氧化钠反应生成碳酸钠,所以两溶液中的碳酸根离子浓度都增大;
B.相同温度下的相同浓度的不同一元酸,酸的酸性越强,则酸的电离程度越大,其阴离子的水解能力越小,混合溶液中,A-、B-都水解导致c(OH-)大于c(HA)、c(HB),据此进行分析;
C.氢氧化钠为强碱,pH相同时其浓度最小;酸根离子对应的酸的酸性越强,其水解程度越小,溶液的pH越小,则pH相同时酸根离子对应的酸的酸性越强,该盐的浓度越大,据此进行判断;
D.酸碱溶液抑制了水的电离,能够水解的盐溶液促进了水的电离.
解答 解:A.分别加入NaOH固体,恢复到原温度,碳酸氢根和氢氧根在溶液反应会生成碳酸根和水,氢氧根对它们的水解均起到抑制作用,所以c(CO32-)均增大,故A正确;
B.乙酸(HA)的酸性比甲酸(HB)弱,则相同浓度的HB的电离程度大于HA,酸的电离程度越大,其酸根离子的水解能力越小,所以A-的水解能力大于B-,水解能力越强,则其溶液中碱性越强,氢氧根离子浓度越大,酸的浓度越小,所以在物质的量浓度均为0.1mol•L-1的NaA和NaB混合溶液中c(HA)>c(HB);因为两种阴离子都水解生成氢氧根离子,所以c(OH-)>(H+),所以离子浓度大小顺序为:c(Na+)>c(B-)>c(A-)>c( OH-)>c(HA)>c(HB)>c(H+),故B正确;
C.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,氢氧化钠溶液为强碱,其浓度最小;水解程度碳酸钠最大、醋酸钠最小,则pH相同时盐的浓度大小为:c(CH3COONa)>c(C6H5ONa)>c( Na2CO3),所以四种物质的浓度关系为:c(CH3COONa)>c(C6H5ONa)>c( Na2CO3)>c(NaOH),故C正确;
D.一定温度下,pH相同的溶液,由水电离产生的c(H+)不一定相同,如:酸碱溶液抑制了水的电离,酸溶液中的氢氧根离子、碱溶液中的氢离子是水电离的,能够水解的盐溶液促进了水的电离,故D错误;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,D为易错点,注意酸碱溶液抑制了水的电离、能够水解的盐溶液促进了水的电离,试题培养了学生导电分析能力及灵活应用能力.


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
 下列说法错误的是( )
下列说法错误的是( )| A. | 对甲苯丙烯酸的分子式为C10H10O2 | |
| B. | 对甲苯丙烯酸能发生的反应类型有加成、取代、氧化 | |
| C. | 对甲苯丙烯酸中所有碳原子有可能共平面 | |
| D. | 对甲苯丙烯酸能使酸性高锰酸钾溶液和溴水褪色,其原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了提取电子垃圾中有用的金属,可将其进行焚烧 | |
| B. | 模型一般可分为物体模型和思维模型 | |
| C. | 某同学研究SO2性质的程序是分类(预测SO2的化学性质)→观察(得出SO2的物理性质)→实验→比较并得出结论 | |
| D. | 科学实验能解决化学学科的所有问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2质量为2g | B. | H2O的摩尔质量为18g | ||
| C. | 标况下44g CO2的体积为22.4L | D. | 9.8g H2SO4含1mol的H2SO4分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
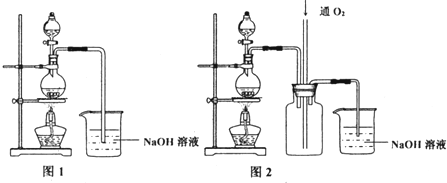
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
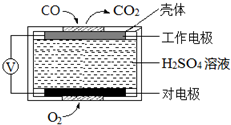 碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.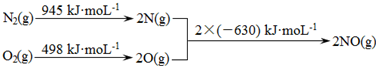
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 T℃时,将一定量的混合气体在密闭容器中发生反应aA(g)+bB(g)?cC(g)+dD(g),平衡后测得B气体的浓度为0.6mol/L,恒温下,将密闭容器中的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4mol/L,下列叙述正确的是( )
T℃时,将一定量的混合气体在密闭容器中发生反应aA(g)+bB(g)?cC(g)+dD(g),平衡后测得B气体的浓度为0.6mol/L,恒温下,将密闭容器中的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4mol/L,下列叙述正确的是( )| A. | 重新达到平衡时,D的体积分数减小 | B. | a+b<c+d | ||
| C. | 平衡向右移动 | D. | 重新达到平衡时,A气体浓度增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com