
| A. | 乙烯 | B. | 二氧化硫 | C. | 氢气 | D. | 乙烷 |
分析 A.乙烯含有碳碳双键,能与溴加成,能被酸性高锰酸钾溶液氧化;
B.SO2具有还原性,能被溴水、酸性高锰酸钾溶液氧化;
C.氢气和溴水、酸性高锰酸钾溶液都不反应;
D.乙烷性质稳定,与酸性高锰酸钾或溴水都不反应.
解答 解:A.乙烯含有碳碳双键,能与溴加成,能被酸性高锰酸钾溶液氧化,原理不同,故A错误;
B.SO2具有还原性,能被溴水、酸性高锰酸钾溶液氧化,原理一致,故B正确;
C.氢气和溴水、酸性高锰酸钾溶液都不反应,故C错误;
D.乙烷性质稳定,与酸性高锰酸钾或溴水都不反应,故D错误;
故选B.
点评 本题主要考查了能使酸性KMnO4溶液褪色和溴水褪色的物质,为高频考点,侧重于二氧化硫和烯烃的考查,难度不大,注意相关知识的积累.


科目:高中化学 来源: 题型:填空题
 天津8.12爆炸事件中,港口保存有NaCN等剧毒物品.
天津8.12爆炸事件中,港口保存有NaCN等剧毒物品.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
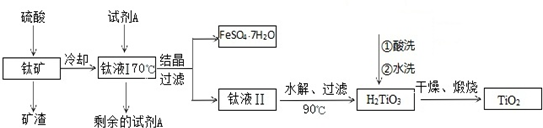
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
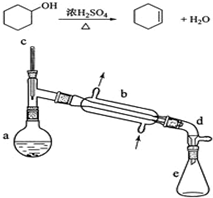 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:| 相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液:K+、Ca2+、HCO3-、NO3- | |
| B. | 存在较多的Na+、SO42-、OH-、的溶液中:Mg2+、Ba2+、Br- | |
| C. | 使紫色石蕊变蓝的溶液:K+、Na+、CH3COO-、SO42- | |
| D. | 由水电离出的c(H+)为1×10-10 mol/L溶液中:K+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com