
| A.在氯化钴溶液中加入一定量的浓盐酸,溶液颜色的变化是由粉红色变为蓝色 |
B.已知I3- I2 + I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 I2 + I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 |
| C.在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸,待产生氢气的速率突然减小,可以判断锌镀层已反应完全 |
| D.标定NaOH溶液的基准物质可用草酸、苯甲酸、邻苯二甲酸氢钾 |
科目:高中化学 来源:不详 题型:填空题
 2C(g)的反应中,时间t与C的体积分数(C%)的函数关
2C(g)的反应中,时间t与C的体积分数(C%)的函数关
 2C(g)是 反应(填“吸热”或“放热”);
2C(g)是 反应(填“吸热”或“放热”); 2C(g)是 反应(填“吸热”或“放热”)。
2C(g)是 反应(填“吸热”或“放热”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
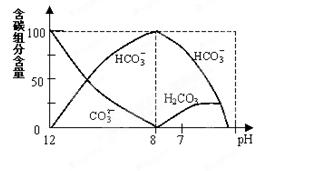
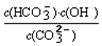 =2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) ΔH1
CH3OH(g) ΔH1 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
 a、容器各物质的浓度保持不变; b、容器内压强保持不变;
a、容器各物质的浓度保持不变; b、容器内压强保持不变; c、υ(CO)消耗==1/2υ(H2)生成 d 、容器内的密度保持不变
c、υ(CO)消耗==1/2υ(H2)生成 d 、容器内的密度保持不变
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+H2 (g)
CO2(g)+H2 (g)| 时间 / min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4mol。
2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4mol。| | 反应前各物质的物质的量/mol | ||
| A | B | C | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0 | 0 | 2 |
| 丙 | 1.5 | 4.5 | 1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g)△H =-a kJ·mol-1。在相同条件下,要想得到2a kJ的热量,加入各物质的物质的量可能是( )
2SO3(g)△H =-a kJ·mol-1。在相同条件下,要想得到2a kJ的热量,加入各物质的物质的量可能是( )| A.4mol SO2和2mol O2 | B.5mol SO2和3mol O2 |
| C.4mol SO2和4mol O2 | D.4mol SO2、2mol O2和2mol SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com