
| A. | ②④ | B. | ③⑤ | C. | ①④ | D. | ②⑤ |
分析 根据c(NaOH)=$\frac{c(盐酸)V(盐酸)}{V(NaOH)}$及不当操作导致V(盐酸)偏小或V(NaOH)偏大,则导致测定结果偏低,以此来解答.
解答 解:①酸式滴定管用蒸馏水洗后未用标准液润洗,V盐酸偏大,c(NaOH)偏高,故不选;
②取待测碱液时滴定管尖嘴处未充满溶液,n(NaOH)偏小,则消耗的V盐酸偏小,则浓度偏低,故选;
③锥形瓶用蒸馏水洗后再用待测液润洗,消耗V盐酸偏大,则浓度偏高,故不选;
④滴定过程中,滴定管活塞处漏出液体,V盐酸偏大,c(NaOH)偏高,故不选;
⑤读取标准溶液体积时,滴定前仰视,滴定后俯视,消耗的V盐酸偏小,则浓度偏低,故选;
故选D.
点评 本题考查中和滴定,为高频考点,把握酸碱中和滴定的实质、误差分析为解答的关键,侧重分析与应用能力的考查,注意结合公式分析误差,题目难度不大.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题
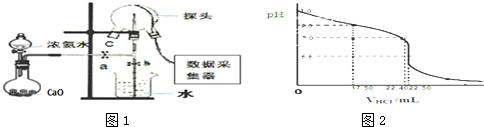
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:| 化合物 | 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | 溶解度 /(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯→乙二醇:CH2═CH2$\stackrel{加成}{→}$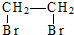 $\stackrel{取代}{→}$ $\stackrel{取代}{→}$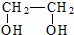 | |
| B. | 溴乙烷→乙醇:CH3CH2Br$\stackrel{消去}{→}$CH2═CH2$\stackrel{加成}{→}$CH3CH2OH | |
| C. | 1-溴丁烷→1,3-丁二烯:CH3CH2CH2CH2Br$\stackrel{消去}{→}$CH3CH2CH=CH2$\stackrel{加成}{→}$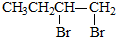 $\stackrel{消去}{→}$CH2═CH-CH═CH2 $\stackrel{消去}{→}$CH2═CH-CH═CH2 | |
| D. | 乙烯→乙炔:CH2═CH2$\stackrel{加成}{→}$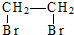 $\stackrel{消去}{→}$CH≡CH $\stackrel{消去}{→}$CH≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二次平衡时,Z的浓度为0.2 mol•L-1 | |
| B. | m=3 | |
| C. | X与Y的平衡转化率之比为1:2 | |
| D. | 加入Z后平衡没移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2=Ca2++ClO-+Cl-+H2O | |
| B. | 向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O | |
| C. | 制备Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com