
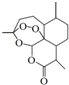
 青蒿素是从植物黄花蒿茎叶中提取的有过氧基团的倍半萜内酯药物.其结构简式如图所示,则下列关于青蒿素的叙述正确的是( )
青蒿素是从植物黄花蒿茎叶中提取的有过氧基团的倍半萜内酯药物.其结构简式如图所示,则下列关于青蒿素的叙述正确的是( )| A. | 青蒿素易溶于水,难溶于乙醇和丙酮等溶剂 | |
| B. | 青蒿素的分子式为:C15H20O5 | |
| C. | 青蒿素因其具有“-O-O-”,所以具有一定的氧化性 | |
| D. | 青蒿素可以与NaOH、Na2CO3、NaHCO3发生反应 |
科目:高中化学 来源: 题型:选择题
| A. | 电解质的电离过程就是产生自由移动离子的过程 | |
| B. | 碳酸钙在水中难溶,但被溶解的碳酸钙全部电离,所以碳酸钙是强电解质 | |
| C. | 氯气和氨气的水溶液导电性都很好,所以它们是强电解质 | |
| D. | 水难电离,纯水几乎不导电,所以水是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| B. | 新制氯水中的所有物质都是电解质 | |
| C. | 氮氧化物、二氧化硫是形成酸雨的主要物质 | |
| D. | 制造光导纤维的原料是晶体硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去硬脂酸钠溶液中的甘油方法是:往溶液中加入饱和食盐水,分液 | |
| B. | 治疗疟疾的青蒿素(如图)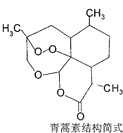 ,分子式是C15H20O5 ,分子式是C15H20O5 | |
| C. | 有机物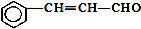 可发生加成反应、氧化反应、还原反应和聚合反应 可发生加成反应、氧化反应、还原反应和聚合反应 | |
| D. | 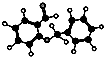 右图所示的有机物分子式为C14H12O2,不能发生银镜反应 右图所示的有机物分子式为C14H12O2,不能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜 | |
| B. | 往海带灰的浸泡液中加入过量的氯水,保证I-完全氧化为I2 | |
| C. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| D. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
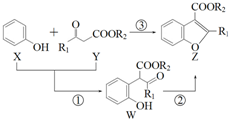 如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述一定正确的是( )
如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述一定正确的是( )| A. | 反应①属于加成反应 | B. | 1molZ完全加成需要3molH2 | ||
| C. | X与W属于同系物 | D. | X、Y、Z、W都能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
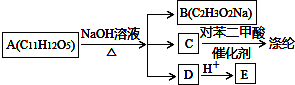


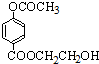 或
或
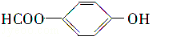
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用米汤检验食盐中是否含碘酸钾(KIO3) | |
| B. | 用食醋除去暖水瓶中的薄层水垢 | |
| C. | 医用酒精的浓度通常为75%,可用于杀菌消毒 | |
| D. | 用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-15 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com