
【题目】根据下面的反应路线及所给信息填空. 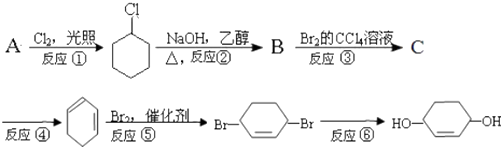
(1)A的结构简式为
(2)在①~⑥的各步反应中,属于取代反应的有 , 属于加成反应的有 .
(3)反应④所用的试剂和条件是 .
(4)反应③的化学方程式是 .
(5)反应⑥的化学方程式是 .
【答案】
(1)![]()
(2)①⑥;③⑤
(3)NaOH、乙醇溶液加热
(4)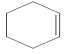 +Br2→
+Br2→ ![]()
(5)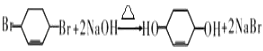
【解析】解:由反应路线可知,A为 ![]() ,反应①为取代反应,反应②为消去反应生成B为
,反应①为取代反应,反应②为消去反应生成B为  ,反应③为C=C的加成反应生成C为
,反应③为C=C的加成反应生成C为 ![]() ,④为消去反应,反应⑤为加成反应,反应⑥为水解反应,(1)由以上分析可知A为
,④为消去反应,反应⑤为加成反应,反应⑥为水解反应,(1)由以上分析可知A为 ![]() ,所以答案是:
,所以答案是: ![]() ;(2)由上述分析可知,①⑥属于取代反应,③⑤为加成反应,所以答案是:①⑥;③⑤;(3)反应④为卤代烃的消去反应,所用的试剂和条件是NaOH、乙醇溶液加热,所以答案是:NaOH、乙醇溶液加热;(4)反应③的化学方程式为
;(2)由上述分析可知,①⑥属于取代反应,③⑤为加成反应,所以答案是:①⑥;③⑤;(3)反应④为卤代烃的消去反应,所用的试剂和条件是NaOH、乙醇溶液加热,所以答案是:NaOH、乙醇溶液加热;(4)反应③的化学方程式为 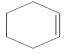 +Br2→
+Br2→ ![]() ,属于加成反应,所以答案是:
,属于加成反应,所以答案是:  +Br2→
+Br2→ ![]() ;(5)反应⑥的化学方程式是
;(5)反应⑥的化学方程式是 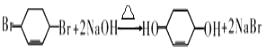 ,所以答案是:
,所以答案是: 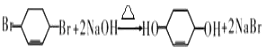 .
.


科目:高中化学 来源: 题型:
【题目】为测定碳酸钙的纯度(设含杂质SiO2),某兴趣小组的同学设计了如下几个实验方案:方案Ⅰ
①称取碳酸钙样品M g
②用c1mol/L的盐酸V1 mL(过量)溶解样品
③取溶解后的溶液体积的十分之一,用c2 mol/L的NaOH溶液滴定,恰用去V2 mL.
方案Ⅱ
①称取碳酸钙样品M g
②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为M1g
方案Ⅲ
①称取碳酸钙样品M g
②加入足量c mol/L的盐酸V mL使之完全溶解
③过滤并取滤液
④在滤液中加入过量c1 mol/L的Na2CO3溶液V1 mL
⑤将步骤④中的沉淀滤出、洗涤、干燥、称重,质量为M1g.
根据以上实验方案,回答以下问题:
(1)方案Ⅰ中计算碳酸钙纯度的公式为 .
(2)方案Ⅱ中的“冷却”应如何操作?;理由是 .
(3)方案Ⅲ中不需要的数据是 (填选项编号).
A.c、V
B.c1、V1
C.M1
D.M
(4)方案Ⅲ中为了减少实验误差,必要的操作是 (填选项编号).
A.精确测定Na2CO3溶液的体积V1 mL
B.精确配制Na2CO3溶液,使其浓度为c1 mol/L
C.将步骤③所得沉淀洗涤,洗涤液并入④中
(5)请再设计一个实验方案:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子晶体中一定含有共价键
B.pH=7的溶液一定是中性溶液
C.含有极性键的分子不一定是极性分子
D.非金属性强的元素单质一定很活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器:烧杯、铁架台(带铁圈)、三脚架、分液漏斗、酒精灯、玻璃棒、蒸发皿和蒸馏烧瓶,从缺少仪器的角度分析,不能进行的实验项目是( )
A. 萃取B. 蒸发C. 分液D. 过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据题目要求完成下列各题:
(1)少量的NaHCO3与Ca(OH)2反应的离子反应方程式____________。
(2)用双线桥标出方程式2KMnO4=K2MnO4 + MnO2 + O2中电子转移的方向和数目______________。
(3)用双线桥标出方程式6HCl + KClO3= KCl +3Cl2 +3H2O 中电子转移的方向和数目_______,并指出氧化产物与还原产物的物质的量的比___________。
(4)在MnO2+4HCl=MnCl2+Cl2+2H2O中氧化剂与还原剂的物质的量的比_______,当0.4molHCl被氧化时,则生成标准状况下的Cl2的体积为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属也能够导电,金属是电解质么?电解质溶液导电和金属导电有何不同?
_______________________,_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由NaHS、MgSO4、NaHSO3组成的混合物中,已知S元素的质量分数w(S)=a%,则O元素的质量分数w(O)为
A. 1-1.75a% B. 1.75a% C.1.25a% D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过利用如图所示装置(夹持装置略去)实验,探究SO2与Na2O2反应的产物 
请分析:
(1)Ⅰ.装置B的作用装置D的作用
Ⅱ.对C中固体产物提出如下假设:假设1:只有Na2SO3 假设2:只有Na2SO4 假设3:
(2)若按假设2进行,反应方程式为
(3)若Na2O2反应完全,为确定C中固体产物的成分,甲同学设计如下实验:得出结论:假设2成立
C中的固体配成溶液 ![]() 白色沉淀
白色沉淀 ![]() 沉淀不溶解
沉淀不溶解
该方案是否合理(填“是”或“否”),理由是
(4)若假设2成立,反应前后C管增加6.4g,请计算10g含有杂质的Na2O2固体中,Na2O2的质量分数为(所含的杂质不与SO2发生反应)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com