
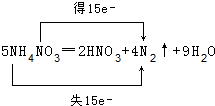
 ;5:3.
;5:3.分析 (1)5NH4NO3═2HNO3+4N2↑+9H2O中,铵根离子中N元素化合价由-3价升高为氮气中的0价,共失去15个电子,被还原的氮元素由硝酸根中+5价降低为氮气中的0价,共获得15个电子;反应中只有氮元素化合价变化,发生氧化反应的氮原子化合价由-3价升高为0价,发生还原反应的氮原子由+5价降低为0价,根据电子转移守恒计算;
(2)在氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性;
(3)根据氧化还原反应中得失电子数相等及质量守恒配平方程式;根据配平后的方程式计算出每有3mol高锰酸根参加反应生成氧气的物质的量.
解答 解:(1)5NH4NO3═2HNO3+4N2↑+9H2O中,铵根离子中N元素化合价由-3价升高为氮气中的0价,共失去15个电子,被还原的氮元素由硝酸根中+5价降低为氮气中的0价,共获得15个电子,用双线桥表示该反应电子转移的方向和数目为: ;
;
反应中只有氮元素化合价变化,发生氧化反应的即被氧化的N元素化合价由-3价升高为0价,发生还原反应的即被还原的氮元素由+5价降低为0价,根据电子转移守恒,被氧化与被还原的N原子个数之比为5:3,
故答案为: ;5:3;
;5:3;
(2)反应Na2S+I2=2NaI+S中,氧化剂是碘单质,氧化产物是S,所以氧化性I2>S,反应O2+4HI═2I2+2H2O 中,氧化剂是氧气,氧化产物是I2,所以氧化性O2>I2,所以氧化性顺序是:O2>I2>S.故答案为:O2>I2>S;
(3)反应中物质的化合价变化:MnO4-→Mn2+,Mn元素化合价由+7价→+2价,一个MnO4-得5个电子;H2O2→O2,
O由-1价变成0价,一个H2O2分子失去2个电子,所以其最小公倍数为10,故MnO4-的计量数为2,双氧水的计量数为5,然后根据原子守恒配平其它元素,配平后的离子方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O;
根据反应可知,3mol高锰酸根离子完全反应生成氧气的物质的量为:3mol×$\frac{5}{2}$=7.5mol,
故答案为:2;5;6;2;5;8;7.5.
点评 本题考查学生氧化还原反应概念、氧化性强弱的判断方法、离子方程式的书写等知识,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
| 方法c | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
| 序号 | 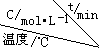 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
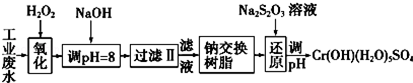
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO、Al2O3的熔点很高,可制作耐高温材料 | |
| B. | 新制氯水久置后变为无色 | |
| C. | 单质硅是光导纤维的主要成分 | |
| D. | 普通玻璃导管口点燃纯净氢气时,火焰呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
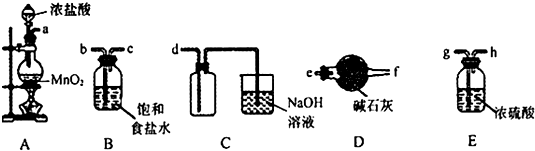
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
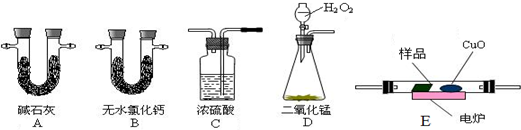
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:Al(OH)3、Mg(OH)2、NaOH | B. | 酸性:HClO4、H2SO4、H3PO4 | ||
| C. | 还原性:HCl、HBr、HI | D. | 原子半径:S、Na、O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com