
【题目】下列离子方程式书写正确的是
A.氢氧化钡溶液与稀硫酸混合:Ba2++SO42-→BaSO4↓
B.Fe与HCl反应:2Fe+6H+→2Fe3++3H2↑
C.碳酸钙跟盐酸反应:CO32-+2H+→CO2↑+H2O
D.醋酸与氢氧化钠溶液反应:CH3COOH+OH-→CH3COO-+H2O
科目:高中化学 来源: 题型:
【题目】如图所示为氢气燃烧的实验。发现烧杯中酸性KMnO4溶液褪色,若将烧杯中的溶液换成含有少量KSCN的FeSO4溶液,溶液呈红色。下列说法不正确的是

A. 将烧杯中溶液换成氢硫酸溶液,溶液无明显变化
B. 与酸性FeSO4溶液发生反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O
C. 该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D. 该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1HA溶液,滴定曲线如图。下列说法不正确的是
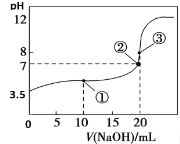
A. 常温下,HA电离常数为1.0×10-6
B. 点②所示溶液中:c(Na+)< c(HA)+c(A-)
C. 点③所示溶液中:c(Na+)> c(A-)> c(OH-)>c(H+)
D. 从点①到点③的滴定过程中,水的电离程度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用以下装置制备并检验 Cl2的性质。下列说法正确的是( )

A.Ⅰ图:若 MnO2 过量,则浓盐酸可全部消耗完
B.Ⅱ图:证明新制氯水具有酸性和漂白性
C.Ⅲ图:产生了棕黄色的雾
D.Ⅳ图:日光照射烧瓶中的饱和氯水会有气泡产生,这是由于氯气光照条件下溶解度下降而逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。 以下是氯元素形成物质的二维图的部分信息。

(1)根据图中信息,写出任意两种氯的含氧酸的化学式_____、_____。
(2)写出 NaOH 溶液吸收 Cl2 的离子方程式_____。
(3)实验室常用高锰酸钾固体与浓盐酸在常温下反应来快速制备少量氯气。反应方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①浓盐酸在上述反应中显示_____(填写序号)。
A 只有还原性 B 只有氧化性
C 既有氧化性又有酸性 D 既有还原性又有酸性
②当反应过程中有 6.02×1022 个电子发生转移时,生成 Cl2 的体积为_____(在标 准状况下),被氧化的 HCl 的物质的量为_____。
(4)潮湿的 Cl2 与 Na2CO3 混合制取少量 Cl2O 的反应中,Cl2既体现了氧化性,也体现了还原性,且生成2种盐。写出反应的化学方程式,并用双线桥标出电子转移的方向和数目_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、I、W、Q在元素周期表中的相对位罝如下图所示,五种元素中有且只有一种金属元素。下列说法不正确的是

A. X与Y或W与Y所形成的化合物可能会引起相同的环境污染
B. 简单离子半径的大小:X>Y>Z>W>Q
C. Z的氢化物具有较强的还原性
D. 最高价含氧酸酸性:Q>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应mA(g) + nB(g)![]() pC(g) + qD(s),达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍,下列说法正确的是
pC(g) + qD(s),达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍,下列说法正确的是
A. m+n < p+q B. 平衡向逆反应方向移动
C. A的转化率提高 D. C的体积分数增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com