
【题目】化学实验在学科中有着非常重要的作用,结合图示实验装置,下列相关分析的描述不正确的是( )
A.图1:盐桥中使用KCl溶液,电子的流向是Zn→G→Cu→CuSO4溶液→盐桥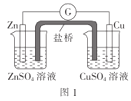
B.图2:可根据该实验验证铁的吸氧腐蚀
C.图3:在强酸和强碱的中和热实验中,强碱的浓度比强酸的略大
D.图4:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断反应2NO2(g)![]() N2O4(g)是一个放热反应
N2O4(g)是一个放热反应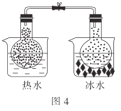
【答案】A
【解析】
A.图1表示的Zn-Cu原电池,Zn失去电子,作负极,电子经过外电,达到正极,电子流向为Zn→G→Cu,但是电子不能经过电解质溶液,也不能经过盐桥,错误,A符合题意;
B.若发生吸氧腐蚀,O2+4e-+2H2O=4OH-,装置中氧气的量减少,右侧导管中的液面会上升,可以证明发生了吸氧腐蚀,正确,B不符合题意;
C.在进行中和热的测定实验时,为了保证强酸完全反应掉,强碱的浓度会比强酸的略大,正确,C不符合题意;
D.根据图示,热水中的烧瓶的颜色更深,NO2的含量很多,可知,升高温度,平衡向着生成NO2的方向移动,则生成NO2的方向为吸热反应方向,可知2NO2(g)![]() N2O4(g)是一个放热反应,正确,D不符合题意。
N2O4(g)是一个放热反应,正确,D不符合题意。
答案选A。


科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. Ksp(CuS)<Ksp[Cu(OH)2]
C. 升高温度![]() 增大
增大
D. 加入MgCl2固体,HS-浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监察局常用“定电位NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示。下列说法不正确的是( )

A.“对电极”是负极
B.“工作电极”上发生的电极反应为NO2+2e-+2H+=NO+H2O
C.传感器工作时H+移向“对电极”
D.“对电极”的材料可能为活泼金属锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原电池的知识,下列反应可设计成原电池的是( )
A.CH3CH2OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
B.Ba(OH)28H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
C.H2SO4+2NaOH=Na2SO4+2H2O
D.CaO+H2O=Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.铅蓄电池放电时,负极质量减轻,正极增重
B.升高CH3COONa溶液的温度,其水的离子积常数和pH均增大
C.CH3CH=CHCH3分子中的四个碳原子都在一条直线上
D.常温下Ksp(AgBr)=5.0×10-13,Ksp(AgCl)=1.8×10-10,则S(AgBr)>S(AgCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监察局常用“定电位NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示。下列说法不正确的是( )

A.“对电极”是负极
B.“工作电极”上发生的电极反应为NO2+2e-+2H+=NO+H2O
C.传感器工作时H+移向“对电极”
D.“对电极”的材料可能为活泼金属锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用所学知识,解决下列问题。
(1)AlCl3溶液呈___(填“酸”“中”或“碱”)性,原因是___(用离子方程式表示)。实验室配制AlCl3溶液时,常将AlCl3固体先溶于较浓的盐酸中,再用蒸熘水稀释到所需的浓度,目的是___。
(2)今有常温下五种溶液:CH3COONa溶液、NH4Cl溶液、NaOH溶液、氨水、NH4HSO4溶液。
①CH3COONa溶液pH___(填“>”“=”或“<” )7,若要使溶液的pH增大,可采取的措施是___。
②pH相等的NaOH溶液和CH3COONa溶液,分别稀释相同倍数后,NaOH溶液的pH___(填“>”“=”“<”)CH3COONa溶液。
③物质的量浓度均为0.1mol·L-1的三种溶液:A.NH4Cl溶液 B.NH4HSO4溶液 C.氨水,c(NH4+)由大到小的顺序为___(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸厂的烟气中含有一定量的氮氧化物(NOx),通常要将烟气中的氮氧化物转化为无毒无害的物质即脱硝。
(1)用空气-水脱硝的方法是最经济的方法。
已知:①2NO(g)+O2(g)=2NO2(g)△H1=-123.4kJ·mol-1
②3NO2(g)+H2O(1)=2HNO3(aq)+NO(g)△H2=-73.6kJ·mol-1
写出NO(g)、O2(g)和液体水反应生成HNO3(aq)的热化学方程式______。
(2)吸收电解法是脱硝的种重要方法。先用稀硝酸吸收NOx、反应生成HNO2(一元弱酸),再将吸收液加入电解槽中进行电解,使之转化为硝酸,其电解装置如下图所示。

①图中a应连接电源的________(正极或负极),其电极反应式为_____。
②电解过程中总反应的化学方程式是_____。有10 mol HNO2参加反应.氧化产物的物质的量是_____。
③阴极区产生1mol氮气时,理论上阳极区减少H+的物质的量约为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,1 L含0.1 mol HA和0.1 mol NaA的溶液a及加入一定量强酸或强碱后溶液的pH如下表(加入前后溶液体积不变):
溶液a | 通入0.01 mol HCl | 加入0.01 mol NaOH | |
pH | 4.76 | 4.67 | 4.85 |
像溶液a这样,加入少量强酸或强碱后pH变化不大的溶液称为缓冲溶液。
下列说法正确的是
A.溶液a和 0.1 mol·L1 HA溶液中H2O的电离程度前者小于后者
B.向溶液a中通入0.1 mol HCl时,A结合H+生成 HA,pH变化不大
C.该温度下HA的Ka=10-4.76
D.含0.1 mol·L1 Na2HPO4 与0.1 mol·L1 NaH2PO4的混合溶液也可做缓冲溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com