
【题目】写出下列有机反应的化学方程式:
(1)用乙炔为原料制备聚氯乙烯(两个反应):______;______。
(2)向苯酚浊液中加入少量氢氧化钠,溶液变澄清;再通入CO2,溶液又变浑浊(两个反应):_____;____。
(3)乙二酸和乙二醇反应生成六元环酯:______。
【答案】![]() nCH2===CH—Cl
nCH2===CH—Cl![]()
![]()
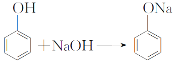 +H2O
+H2O 
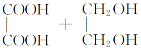
![]()
![]() +2H2O
+2H2O
【解析】
用乙炔为原料制备聚氯乙烯的途径是:乙炔先和氯化氢发生加成反应,生成氯乙烯,然后在进行加聚反应生成聚氯乙烯;(2)向苯酚浊液中加入少量氢氧化钠,生成苯酚钠;苯酚钠中通入CO2,生成苯酚和碳酸氢钠;乙二酸和乙二醇中的羟基与羧基分别发生酯化反应生成六元环酯和水。
(1)用乙炔为原料制备聚氯乙烯的途径是:乙炔先和氯化氢发生加成反应,生成氯乙烯,然后在进行加聚反应生成聚氯乙烯,反应的方程式为:![]() 、nCH2=CH—Cl
、nCH2=CH—Cl![]()
![]() 。
。
(2)苯酚溶液显弱酸性,加NaOH溶液发生反应生成苯酚钠,反应方程式: C6H50H+NaOH![]() C6H50Na+H2O;苯酚钠中通入CO2,生成苯酚和碳酸氢钠,所以反应方程式为:C6H50 + CO2 + H2O
C6H50Na+H2O;苯酚钠中通入CO2,生成苯酚和碳酸氢钠,所以反应方程式为:C6H50 + CO2 + H2O![]() C6H50H+ NaHCO3。
C6H50H+ NaHCO3。
3)乙二酸和乙二醇发生酯化反应生成六元环酯的方程式为: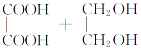
![]()
![]() +2H2O。
+2H2O。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】在元素周期表中,在金属元素和非金属元素分界线附近能找到( )
A. 制半导体的元素B. 制催化剂的元素
C. 制农药的元素D. 制耐高温合金的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列各项事实能说明上述观点的是
A. 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能使酸性高锰酸钾溶液褪色
B. 丙烯和丙炔都能使溴水褪色
C. 等物质的量的乙醇和甘油与足量的金属钠反应,后者产生的氢气比前者多
D. 苯酚可以与NaOH反应,而环己醇不可以
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应N2(g)+3H2(g) ![]() 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为
A.1.2mol/(L·min)B.1.8mol/(L·min)
C.0.6mol/(L·min)D.0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.硫与铁反应生成硫化铁
B.硫化氢中硫元素只表现氧化性
C.二氧化硫具有漂白性,可以使酸碱指示剂褪色
D.浓硫酸可以使小木条变黑,体现了浓硫酸的脱水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理B2O3+3C+3Cl2 =2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。已知:BCl3的熔点为-107.3℃,沸点为12.5℃,遇水水解生成H3BO3和HCl,请回答下列问题:
(实验Ⅰ)制备BCl3并验证产物CO
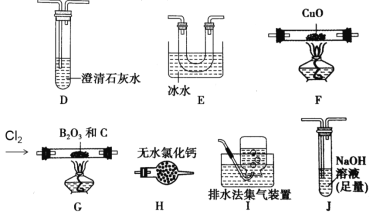
(1)该实验装置中合理的连接顺序为G→_____→_____→_____→____→F→D→I。其中装置E的作用是___________________________。
(2)装置J中反应的化学方程式为____________________________________。
(实验Ⅱ)产品中氯含量的测定
①准确称取少许m克产品,置于蒸馏水中完全水解,并配成100mL溶液。
②取10.00mL溶液于锥形瓶中
③加入V1mL浓度为C1 mol/LAgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用C2 mol/L KSCN标准溶液滴定过量的AgNO3溶液。发生反应:Ag+ +SCN- =AgSCN↓。
⑤重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2 mL。
已知: Ksp(AgCl)>Ksp(AgSCN) 。
(3)步骤④中达到滴定终点的现象为__________________。
(4)实验过程中加入硝基苯的目的是___________________。
(5)产品中氯元素的质量分数为_________________%。
(6)下列操作,可能引起测得产品中氯含量偏高是__________。
A.步骤③中未加硝基苯
B.步骤①中配制100mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化铁样品中含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上述流程,回答以下问题:
(1)操作I是配制一定物质的量浓度的溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_________、__________(填仪器名称)。
(2)下列操作可能使所配溶液浓度偏小的是___________(填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(3)请写出上图中滴加氯水后所发生反应的离子方程式____________________。
(4)检验沉淀是否已经洗涤干净的操作是____________。
(5)样品中铁元素的质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是
A.1L 1mol·L-1的NaOH溶液中含有NA个氧原子
B.常温常压下,14gCO和N2混合气所含质子总数为7NA
C.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
D.标准状况下,11.2L氦气所含的原子数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.煤的气化、煤的液化都是物理变化
B.石油是由多种烃组成的混合物
C.汽油都不能使溴水褪色
D.乙烷的产量可以衡量一个国家石油化工的发展水平
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com