
| A、强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| B、因为CH3COOH是弱电解质,HCl是强电解质,所以中和等体积等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比盐酸消耗的NaOH用量少 |
| C、物质的量浓度相同的磷酸钠溶液和磷酸溶液中PO43-的物质的量浓度相同 |
| D、足量Zn分别和等体积、等物质的量浓度的盐酸和醋酸反应时,产生H2的量相同,放出H2的速率不等 |


科目:高中化学 来源: 题型:
| A、明矾是一种复盐,则NaAlO2也是一种复盐 |
| B、CaCO3的溶解度小于Ca(HCO3)2,则Na2CO3的溶解度小于NaHCO3 |
| C、在Ca(ClO)2溶液中分别通入CO2、SO2,前者生成CaCO3沉淀,则后者也生成CaSO3沉淀 |
| D、S、Cl两种元素为同周期元素,H2SO4为强酸,则HClO4也为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
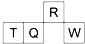 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )| A、原子半径:Q>T>R |
| B、最高价氧化物对应水化物的酸性:Q<W |
| C、气态氢化物的稳定性:R>Q |
| D、Q的氧化物只能与碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
| B、NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) |
| C、CH3COOH溶液中加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、中和体积与pH值都相同的盐酸和醋酸溶液,所消耗NaOH的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
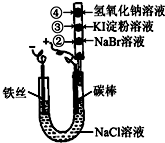 某化学兴趣小组按如图所示的装置进行实验,玻璃管内装有滴有不同溶液的白色棉球.实验过程中,两极均有气体生成.则下列说法错误的是( )
某化学兴趣小组按如图所示的装置进行实验,玻璃管内装有滴有不同溶液的白色棉球.实验过程中,两极均有气体生成.则下列说法错误的是( )| A、碳棒的电极反应式为2Cl--2e-=Cl2↑ | ||||
| B、②处、③处白色棉球分别变为橙黄色、蓝色 | ||||
C、如图X、Y两条线分别表示常见的非金属单质和金属单质(用M表示)与碳棒电解产物单质E在点燃条件下进行化合反应的物质的量之间的关系.写出符合Y线反应的化学方式Mg+Cl2
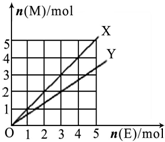 | ||||
| D、在20℃时饱和食盐水的质量分数为26%,当阳极析出1.12L(标准状况下)气体时,Cl-完全放电.试计算要使溶液恢复原状态,需加入3.65gHCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
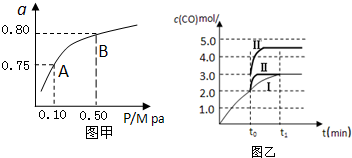
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上电解NO制备 NH4NO3,其工作原理如图所示,电解时阳极的电极反应为
工业上电解NO制备 NH4NO3,其工作原理如图所示,电解时阳极的电极反应为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com