
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,根据如图所示的实验装置,回答下列问题:
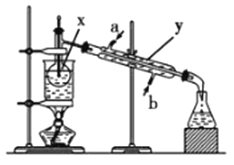
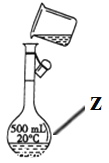
(1)写出下列仪器的名称:x_________;y_____________;z_____________。
(2)仪器y的进水口为_____________(填“a”或“b”)。
(3)请分别指出图中的一处错误_____________________,_________________。
(4)在配置1.0mol/L盐酸溶液时,下列操作会导致所配溶液浓度偏大的是___________(填写字母,下同);浓度不变的是_______。
A.用量筒量取浓盐酸时,俯视量筒刻度线
B.容量瓶未干燥即用来配置溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容后,将容量瓶倒置摇匀,发现液面低于刻度线,继续加水至刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
F.未进行洗涤操作
【答案】蒸馏烧瓶 冷凝管 500mL容量瓶 b 温度计水银球伸入液面下 未用玻璃棒引流 E B
【解析】
(1)由图及常见仪器可知名称;
(2)根据冷水在冷凝管中下进上出,冷凝效果好判断;
(3)根据装置判断其错误;
(4)结合c=n÷V及不当操作对n、V的影响分析。
(1)根据仪器的构造可知x、y、z分别是蒸馏烧瓶、冷凝管、500mL容量瓶。
(2)蒸馏时为充分冷却,冷凝管下口是进水口,上口是出水口,因此仪器y的进水口为b。
(3)蒸馏时温度计测量的是蒸汽的温度,不是溶液的温度,则装置中的错误是温度计水银球伸入液面下;配制一定物质的量浓度的溶液时必须用玻璃棒引流,防止液体外溅,因此装置中的错误是未用玻璃棒引流;
(4)A.用量筒量取浓盐酸时,俯视量筒刻度线,实际量取的盐酸减少,所以所配溶液的浓度偏小;
B.容量瓶未干燥即用来配置溶液,n、V均无影响,则浓度不变;
C.浓盐酸在烧杯中稀释时,搅拌时间过长,盐酸挥发,溶质的物质的量减少,所以所配溶液的浓度偏小;
D.定容后,将容量瓶倒置摇匀,发现液面低于刻度线,继续加水至刻度线,溶液的体积增加,所以所配溶液的浓度偏小;
E.在容量瓶中定容时俯视容量瓶刻度线,V偏小,所以所配溶液的浓度偏大;
F.未进行洗涤操作,溶质的物质的量减少,所以所配溶液的浓度偏小;
因此所配溶液浓度偏大的是E;浓度不变的是B。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
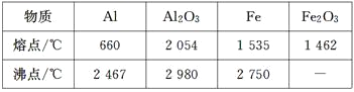
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为__________________________________________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
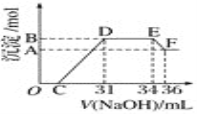
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为_________________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为___________;上述现象说明溶液中________结合OH-的能力比________强(填离子符号)。
(3)B与A的差值为________mol。
(4)B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请将符合题意的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
(1)化学键没有被破坏的是__________;仅发生离子键破坏的是__________;
(2)即发生离子键破坏、又发生共价键破坏的是____________________;
(3)N2的电子式为__________;Na2O2的电子式为___________;CO2的电子式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以锌锰废电池中的碳包(含碳粉、Fe、Cu、Ag和MnO2等物质 )为原料回收MnO2的工艺流程如下:
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
II.将滤渣a在空气中灼烧除去碳粉,得到粗MnO2;
III.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
IV. 向III所得溶液(pH约为6)中缓慢滴加0.50 molL-1 Na2CO3溶液,过滤,得滤渣b,其主要成分为MnCO3;
V. 滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι中Ag与足量稀HNO3反应生成NO的化学方程式为____________________。
(2)已知II的灼烧过程中同时发生反应:
MnO2(s)+C(s) = MnO(s) + CO (g) △H=+24.4 kJ mol -1
MnO2(s)+CO(g) = MnO(s)+CO2(g) △H=-148.1 kJ mol -1
写出MnO2和C反应生成MnO和CO2的热化学方程式:________。
(3)H2O2分子中含有的化学键类型为________、________。
(4)III中MnO2溶解的离子方程式为________,溶解一定量的MnO2,H2O2的实际消耗量比理论值高,用化学方程式解释原因:______________________________________。
(5)IV中,若改为“向0.50 molL-1 Na2CO3溶液中缓慢滴加III所得溶液”,滤渣b中会混有较多Mn(OH)2沉淀,解释其原因:________________________________________。
(6)V中MnCO3在空气中灼烧的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甘氨酸(H2N-CH2-COOH)性质的说法中正确的是
A. 只有酸性,没有碱性B. 只有碱性,没有酸性
C. 既有酸性,又有碱性D. 既没有酸性,又没有碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入1 mol X与2 mol Y发生反应:X(g)+2Y(g) ![]() aZ(g) ΔH<0,达到平衡后,改变某一条件(温度或容器体积),X的平衡转化率的变化如图所示。下列说法中正确的是( )
aZ(g) ΔH<0,达到平衡后,改变某一条件(温度或容器体积),X的平衡转化率的变化如图所示。下列说法中正确的是( )

A. a =2 B. T2>T1
C. A点的反应速率:v正(X)=![]() v逆(Z) D. 用Y表示A、B两点的反应速率:v(A)>v(B)
v逆(Z) D. 用Y表示A、B两点的反应速率:v(A)>v(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法不正确的是
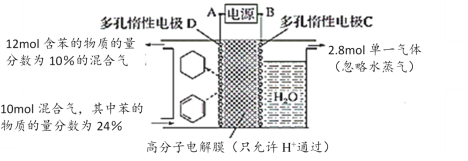
A. 电源A为负极,电极C为阳极
B. 单一气体为O2
C. 该储氢装置的电流效率约为32.1%(电流效率计算公式为=![]() ×100%)
×100%)
D. 电子流动方向为:A→D;C→B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有 K+、NH4+、Ca2+、Cl–、SO42–、CO32–中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验:(所加试剂均过量,气体全部逸出)下列说法不正确的是

A. 原溶液中一定存在SO42–、CO32–和NH4+
B. 原溶液中一定不存在Ca2+,无法判断Cl–是否存在
C. 要确定Cl–是否存在,可取少许溶液2加入硝酸银和稀硝酸检验
D. 原溶液中 c(K+ )≥0.1 mol· Lˉ 1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com