
 氨气在生产、生活和科研中应用十分广泛.
氨气在生产、生活和科研中应用十分广泛.分析 (1)①运用盖斯定律,将所给的反应通过加减乘除等变形得到所要求的目标反应,反应热做相应变化即可;
②根据液氨的电离方程式,结合尿素的化学式为CO(NH2)2来分析;
(2)①氨气分解为熵增的反应,根据△G=△H-T△S<0,反应可以自发进行;
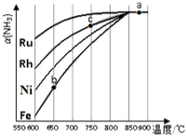
②根据图可知,在600℃时催化效果最好的是Ru,b、c点均未达到平衡,c点温度较高,反应速率较快;
(3)根据信息:该电解池(电极为惰性材料)电解除去NH3,净化污水.该净化过程分两步:第一步电解产生氧化剂,即产生能将氨氧化为氮气的物质,第二步氧化剂氧化氨氮物质生成N2,据电解池的工作原理结合发生的反应来回答;
解答 解:(1)①已知:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.47kJ•mol-1 ①
NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+72.49kJ•mol-1 ②
将①+②可得:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)△H=(-159.47kJ•mol-1)+(+72.49kJ•mol-1)=-86.98KJ/mol,
故答案为:-86.98;
②由于液氨的电离方程式为2NH3(l)?NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,而尿素的化学式为CO(NH2)2,可知该反应的化学方程式为COCl2+4NH3=CO(NH2)2+2NH4Cl,故答案为:COCl2+4NH3=CO(NH2)2+2NH4Cl;
(2)①△G=△H-T△S<0,反应可以自发进行,氨气分解为熵增的反应,且△H为增大反应,故反应在高温下可以自发进行,
故答案为:高温;
②根据图可知,在600℃时催化效果最好的是Ru,b、c点均未达到平衡,c点温度较高,反应速率较快,氨气的转化率较高,
故答案为:Ru;b、c点均未达到平衡,c点温度较高,反应速率较快,氨气的转化率较高,且Rh比Fe的催化能力强;
(3)①根据图示知道:A电极是电解池的阳极,该电极上发生失电子的氧化反应,可以得到氧化剂,根据离子的放电顺序,即氯离子失电子产生氯气的过程,电极反应式为:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
②第二步氧化剂氯气氧化氨氮物质即氨气生成N2的过程,发生的反应为:3Cl2+2NH3=N2+6HCl,
故答案为:3Cl2+2NH3=N2+6HCl或3Cl2+8NH3=N2+6NH4Cl.
点评 本题考查了盖斯定律的应用以及根据新信息来书写化学方程式,电解池的工作原理以及电极反应式的书写知识,注意新信息的提取,注意题干信息的应用是关键,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日常生中无水乙醇常用于杀菌消毒 | |
| B. | 目前加碘盐中主要添加的是KI | |
| C. | 绿色食品是不含任何化学物质的食品 | |
| D. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中硫酸作氧化剂 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 刺激性气味的气体是氨气 | |
| D. | 1mol NH4CuSO3完全反应转移0.5mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,SO2(g)和O2(g)所具有的能量大于SO3所具有的能量 | |
| B. | 将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后,放出热量为QkJ | |
| C. | 增大压强或升高温度,该平衡都向逆反应方向移动 | |
| D. | 如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2molSO2(g)被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下Fe与水蒸气反应可生成Fe3O4和H2 | |
| B. | Cu与冷的浓硫酸因发生钝化,反应难以进行 | |
| C. | Na2O、Na2O2与CO2反应,产物均相同 | |
| D. | 向AlCl3溶液中逐滴加氨水,产生白色沉淀,过量时,沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200 mL 2 mol/L MgCl2溶液 | B. | 400 mL 2.5 mol/L NaCl溶液 | ||
| C. | 250 mL 1 mol/L AlCl3溶液 | D. | 300 mL 5 mol/L KClO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
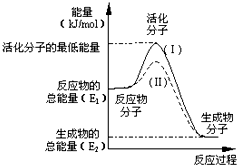 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变为活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变为活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com