
分析 结合n=$\frac{m}{M}$、c=$\frac{n}{V}$及物质构成计算.
解答 解:(1)n(Na2SO4)=$\frac{7.1g}{142g/mol}$=0.05mol,c(Na2SO4)=$\frac{0.05mol}{0.5L}$=0.1mol/L,
答:该溶液中硫酸钠的物质的量浓度为0.1mol/L;
(2)由Na2SO4=2Na++SO42-,溶液中阴阳离子的总物质的量为0.05mol+0.05mol×2=0.15mol,
答:溶液中阴阳离子的总物质的量为0.15mol.
点评 本题考查物质的量浓度的计算,为高频考点,把握物质的量、质量及浓度的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
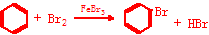 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g | B. | 10g | C. | 10.2g | D. | 11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等 | |
| B. | 常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7 | |
| C. | 将0.2 mol•L-1NaA溶液和0.1 mol•L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| D. | 0.1 mol•L-1 Na2CO3溶液中:c(Na+)=c(HCO${\;}_{3}^{-}$)+c(H2CO3)+2c(CO${\;}_{3}^{2-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
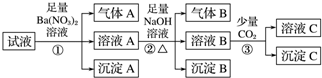
| A. | 原溶液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 原溶液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为2AlO-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.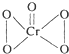 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
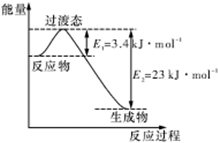 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| B. | 喝补铁剂时,加服维生素C,效果更好,原因是维生素C具有氧化性 | |
| C. | 食用花生油和鸡蛋清都能发生水解反应 | |
| D. | “地沟油”经加工处理后,可用于生产肥皂和生物柴油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
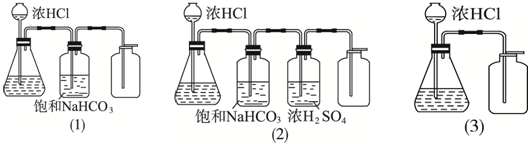
| A. | (1)(2)(3)一样重 | B. | (1)中最重 | C. | (2)中最重 | D. | (3)最轻 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com